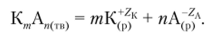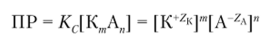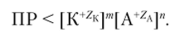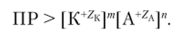При растворении малорастворимого химического соединения-электролита в системе быстро устанавливается равновесие между раствором и осадком. Растворенная часть малорастворимого соединения практически полностью диссоциирует на ионы. Это становится понятно, если принять во внимание редкость столкновений сольватированных частиц, образующихся из растворенного соединения в разбавленных растворах. Поэтому малорастворимые электролиты являются сильными. Состояние равновесия в таких системах может быть описано схемой.
Поскольку концентрации катионов К*2к и анионов, А 2л малы, то раствор можно считать идеальным. Выражение для константы равновесия записывается так:
Поскольку концентрация вещества [ Кт А"] в твердой фазе постоянна, то ее можно перенести в левую часть выражения для константы равновесия, в результате выражение в левой части останется константой, и оно называется произведением растворимости (ПР) малорастворимого сильного электролита: 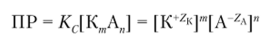
В правой части уравнения получилось произведение равновесных концентраций ионов, на которые диссоциирует в растворе малорастворимый сильный электролит. Эти концентрации берутся в степенях, равных стехиометрическим коэффициентам уравнения диссоциации.
Чем меньше ПР, тем хуже растворяется соединение. Но не следует сравнивать растворимость по абсолютной величине ПР, поскольку оно зависит от концентраций нелинейно — концентрации входят в него в степенях, равных стехиометрическим коэффициентам диссоциации. Величина ПР определяет и условия образования осадка при смешении растворов различных концентраций. Осадок из раствора выделяется, если произведение текущих концентраций ионов в степенях, равных стехиометрическим коэффициентам, больше ПР: 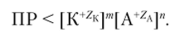
Осадок растворяется, если произведение текущих концентраций ионов в степенях, равных стехиометрическим коэффициентам, меньше ПР: