Свойства.
Органическая химия

Высоконуклеофильный амид-анион присоединяется в положение 2 с образованием анионного а-аддукта (855), где наиболее устойчивая резонансная структура — (855а) (противоион Na+ на этой стадии опущен). Далее от а-аддукта отщепляется гидрид-ион в виде гидрида натрия (а-аддукт представлен формой (855а), т.к. резонансный гибрид близок к ней по структуре). В условиях реакции (в безводной среде) гидрид… Читать ещё >
Свойства. Органическая химия (реферат, курсовая, диплом, контрольная)
Ароматический характер пиридина, как и бензола, обусловлен циклическим сопряжением шести я-электронов, принадлежащих трем я-связям; неподеленная пара электронов атома азота не участвует в сопрялсении; ее орбиталь ортогональна ароматической. Пиридин в большей степени, чем пятичленные гетероциклы, напоминает бензол; однако, появление в кольце атома азота вместо группы СН придает молекуле пиридина заметную специфику. Пиридин можно представить как резонансный гибрид структур (851а-е):
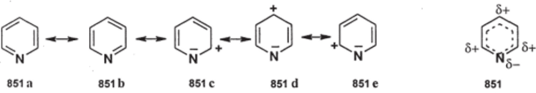
851Л 851Ь 851С 851 d 851 е 851.
Рассмотрение электронной структуры пиридина позволяет сделать выводы:
- 1. Пиридин стабильнее пиррола и других пятичленных гетероциклов, т.к. для него возможны две эквивалентные незаряженные структуры (8513,6/
- 2. п-Электронная плотность на атомах углерода меньше, чем в бензоле, особенно в положениях 2,4 и 6; пиридин относится к п-дефицитным гетероциклам. Поэтому он должен труднее бензола реагировать с электрофилами, но легче — с нуклеофилами. В этом отношении пиридин напоминает производные бензола, содержащие электроноакцепторные заместители; часто пиридин сравнивают с нитробензолом.
- 3. Поскольку неподеленная пара электронов атома азота не участвует в делокализации, пиридин должен проявлять свойства основания и нуклеофила, т. е. свойства амина.
- 4. Благодаря электроотрицательному атому азота пиридиновое ядро проявляет заметный — 1-эффект, а в случае сопряжения — иМ-эффект; поэтому для замещенных пиридина наблюдается повышенная СН-кислотность связей С-Н, соседних с пиридиновым ядром, особенно для заместителей в положениях 2,4,6, где проявляетсяМ-эффект пиридинового ядра. .
I. Производные пиридина как третичные амины.
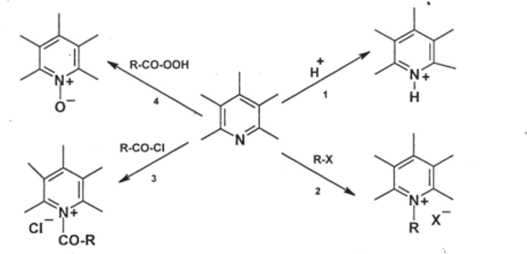
4. Важным превращением производных пиридина является их окисление надкислотами; при этом, по аналогии с третичными аминами, образуются Nоксиды пиридинов эти соединения активнее исходных пиридинов в некоторых реакциях как электрофильного, так и нуклеофильного замещения.
II. Электрофильное замещение в пиридиновом ядре.
А. Пиридин и его N-незамещенные производные.
Электрофильное замещение в ядре пиридина протекает с трудом — примерно на 6 порядков труднее, чем в бензоле; это — следствие л-дефицитности пиридинового цикла. Реакции проходят только в очень жестких условиях; заместитель ориентируется в положение 3:
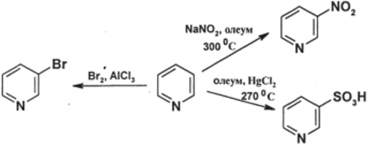
Удается осуществить нитрование, сульфирование и галогенирование; алкилирование и ацилирование по Фриделю-Крафтсу не идут.
Как реакционную способность, так и регионаправленность замещения можно объяснить, если рассмотреть структуры а-аддуктов при замещении в положениях 2 и 3:
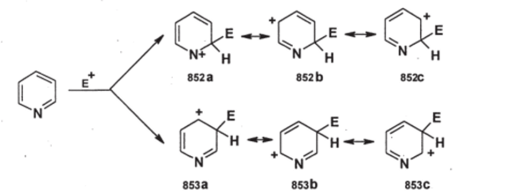
Электроноакцепторный атом азота уменьшает стабильность катионных а-аддуктов (852) и (853), что снижает скорость замещения (в действительности обычно в реакцию вступает не пиридин, а катион пиридиния, образующийся при протонировании кислотой; в этом катионе атом азота много более акцепторный, чем в пиридине; это еще более затрудняет замещение). При замещении в положении 2 образуется максимально нестабильная форма (852а), в которой положительный заряд локализован на электроноакцепторном атоме азота; при замещении в положении 3 такой формы не возникает, и а-аддукт относительно более устойчив, точнее менее неустойчив. Таким образом, происходит выбор «лучшего из худшего», как при замещении в бензольном ядре, содержащем ориентант II рода, например, в нитробензоле.
Производные пиридина, содержащие электронодонорные группы, реагируют легче. Уже 2,6-диметилпиридин (2,6-лутидин) нитруется при 100 °C с высоким выходом (в то время как пиридин при 300 °C — с выходом 5%): пиридиновый аналог фенола — 2-гидроксипиридин — может образовать даже динитропроизводное, хотя, конечно, менее активен, чем фенол:
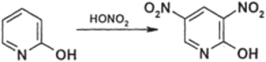
Б. N-оксиды пиридина и его производных. Эти соединения заметно активнее N-незамещеных пиридинов в реакциях нитрования; при этом нитрогруппа становится в положение 4:
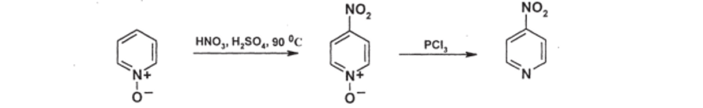
Полученный 4-нитро-Ы-оксид может быть дезоксигенирован действием РСЬ; таким образом, открывается возможность синтеза 4-нитропиридинов (а исходя из них — и других 4-замещенных пиридинов). Ориентация в положение 4 вытекает из структуры о-аддукта:
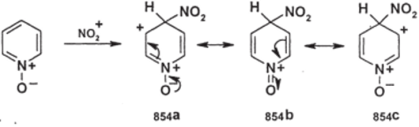
854а 854 b 854С Набор резонансных структур включает весьма стабильную структуру (854Ь), имеющую только один заряд, причем на аммонийном атоме азота. При замещении в положении 3 такой устойчивой формы не образуется.
III.Взаимодействие производных пиридина с нуклеофильными реагентами.
Пиридин, как л-дефицитная структура, обладает большим сродством к нуклеофильным реагентам, чем бензол. При действии нуклеофильных реагентов на пиридин и его N-незамещенные производные происходят, в основном, реакции замещения. При действии нуклеофилов на соли пиридиния могут происходить как реакции замещения, так и реакции присоединения.
А. Нуклеофильное замещение водорода. В достаточно жестких условиях атом водорода в положении 2 можно заместить на группы NH2 и ОН:
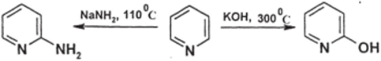
Реакцию с амидом натрия называют реакцией Чичибабина; она позволяет получать 2-аминопиридины с хорошим выходом и имеет заметное практическое значение как успешная реакция прямого аминирования ароматического ядра. Реакция гидроксилирования ядра при действии расплавленного КОН дает низкие выходы продуктов; однако для конденсированных систем с пиридиновым ядром результаты этой реакции лучше.
Реакции протекают по схеме присоединения-отщепления; в частности, наиболее вероятный механизм реакции Чичибабина следующий:
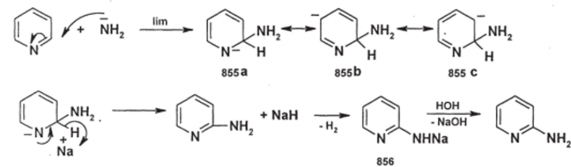
Высоконуклеофильный амид-анион присоединяется в положение 2 с образованием анионного а-аддукта (855), где наиболее устойчивая резонансная структура — (855а) (противоион Na+ на этой стадии опущен). Далее от а-аддукта отщепляется гидрид-ион в виде гидрида натрия (а-аддукт представлен формой (855а), т.к. резонансный гибрид близок к ней по структуре). В условиях реакции (в безводной среде) гидрид натрия реагирует с 2- аминопиридином с выделением водорода и образованием пиридиламида натрия (856) (здесь аминопиридин проявляет свойства слабой кислоты); при добавлении воды происходит его гидролиз и регенерация 2-аминопиридина.
Регионаправленность процесса очевидна: при замещении в положении 3 устойчивость а-аддукта меньше, т.к. здесь не образуется резонансной структуры с отрицательным зарядом на атоме азота.
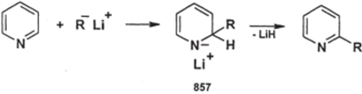
Еще один вариант нуклеофильного замещения водорода в пиридиновом ядре — реакции с металлорганическими соединениями; лучше всего они протекают с литийорганическими соединениями:
оэ/.
В результате происходит алкилирование или арилирование в положение 2. Механизм подобен механизму реакции Чичибабина; интересно то, что в некоторых случаях удается выделить промежуточные аддукты — Ы-литий-1,2- дигидропиридины (857); их можно использовать в различных синтезах.
Б. Нуклеофильное замещение галогена. Атомы галогена в 2- и 4- галогензамещенных пиридинах достаточно легко замещаются при взаимодействии с нуклеофильными реагентами:
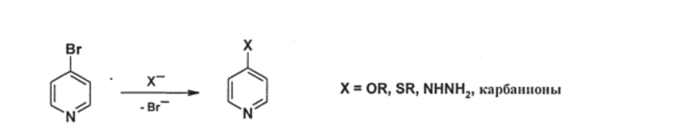
Ситуация напоминает галоген нитробензолы. В большинстве случаев реакции идут по типу присоединения-отщепления с образованием анионных ст-аддуктов типа комплексов Мейзенгеймера.
Для N-оксидов галогенпиридинов замещение галогена идет еще легче:
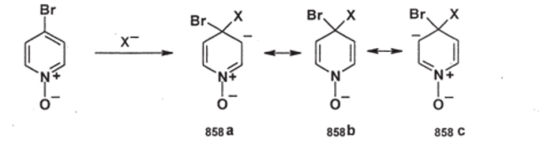
В анионном ст-аддукте здесь присутствует устойчивая структура (858Ь), что и делает его более стабильным. Таким образом, N-оксидная группа активирует пиридиновое ядро по отношению и к электрофильным и к нуклеофильным реагентам. 2- и 4-Галогензамещенные пиридиниевые соли также очень легко замещают атомы галогена.
З-Галогенпроизводные пиридина реагируют с нуклеофилами труднее, чем.
2- и 4-галогенпроизводные. Если в качестве нуклеофила использовать очень сильное основание (амид калия), то замещение идет по схеме отщепленияприсоединения — по аринному механизму с промежуточным образованием дегидропиридина (859); разумеется, при этом наряду с «правильным» замещением [соединение 860)] идет кмне-замещение [соединение (861)]:
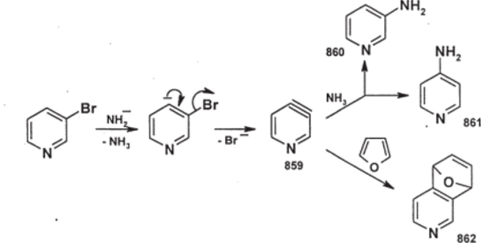
Промежуточно образующийся дегидропиридин (859) можно «поймать» химической ловушкойдиеном (см. стр. 212, ч. 1); при использовании в качестве такой ловушки фу рана (стр. 236) можно выделить аддукт диенового синтеза (862).
В. Нуклеофильное присоединение к солям пиридиния. Для солей пиридиния характерно присоединение достаточно сильных нуклеофилов в положение 2 или 4 с образованием производных 1,2- или 1,4-дигидропиридина:
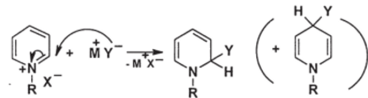
Так присоединяется цианид-анион (М=К, Y=CN) — преимущественно в положение 4, алкоксид-анион (M=Na, Y=OR) — в положение 2, реактивы Гриньяра (M=MgX, Y=R) — преимущественно в положение 2.
В некоторых случаях вслед за присоединением нуклеофила следует раскрытие пиридиниевого цикла, например, при реакции солей Nарилпиридиния с аминами:
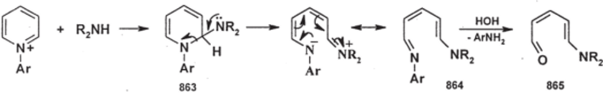
В продукте присоединения (863) происходит внутримолекулярное нуклеофильное замещение с раскрытием цикла; образующийся арилимин (864) гидролизуется водой; конечным продуктом является 5-аминопентадиеналь (865).
IV. Реакции ct-положения к пиридиновому ядру.
Метальная и метиленовая группа при С2 и С4 пиридинового цикла обладают повышенной СН-кислотностью, потому что карбанионы, образующиеся при депротонировании этих групп, стабилизированы делокализацией, причем образуется стабильная резонансная структура (866):
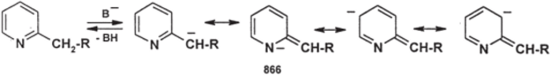
Поэтому 2- и 4- алкилпиридины могут выступать в роли метиленовых компонент при конденсации с карбонильными соединениями, обычно альдегидами; эти реакции проходят в присутствии уксусного ангидрида или ZnCl2:
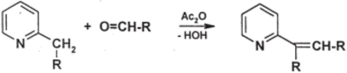
Особенно хорошо идут конденсации с ароматическими альдегидами.
Для 3-алкилпиридинов стабилизация карбаниона меньше, т.к. невозможно образование резонансной структуры с отрицательным зарядом на атоме азота;
3-алкилпиридины не вступают в реакции конденсации.
Метиленовые группы при С2 и С4 в N-оксидах пиридинов и солях пиридиния еще более активны, чем в N-незамещенных пиридинах; например, Nоксид 2-метилпиридиния конденсируется даже с нитрозосоединениями, которые менее электрофильны, чем альдегиды и кетоны:
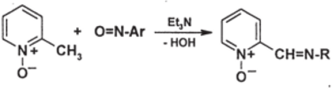
V. Реакции окисления и восстановления А. Окисление. Пиридиновое ядро еще более, чем бензольное, устойчиво к действию многих сильных окислителей (не считая надкислот). Алкильные боковые цепи, как и в алкилбензолах, при действии сильных окислителей превращаются в карбоксильные группы:
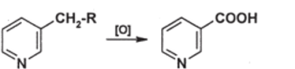
Б. Восстановление. Пиридиновое ядро восстанавливается легче, чем бензольное. В отличие от производных бензола, производные пиридина могут восстанавливаться натрием в спирте и комплексными гидридами. Натрий в этаноле восстанавливает пириДины в гексагидропиридины (, пиперидины) этот вариант называют реакцией Вышнеградского-Ладенбурга. При действии алюмогидрида лития восстановление обычно останавливается на стадии образовании дигидропиридинов, причем часто образуются смеси 1,2- и 1,4- изомеров:
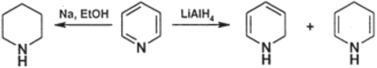
При действии. натрия в апротонных растворителях происходит восстановительная димеризация с образованием в конечном счете производных 4,4'-бипиридила (870):
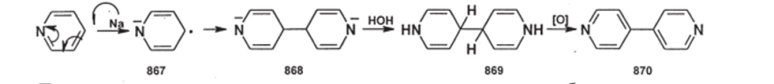
При одноэлектронном восстановлении пиридинового ядра образуется анионрадикал (867); димеризация анион-радикалов приводит к дианиону (868), который при добавлении воды дает тетрагидробипиридил (869), легко окисляющийся до бипиридила (870).
Соли пиридиния восстанавливаются легче пиридинов; в частности, они восстанавливаются не только алюмогидридом лития, но и менее активным борогидридом натрия. Продуктами восстановления являются дии тетрагидропиридины; восстановление идет не всегда селективно, и часто образуются смеси продуктов, как в приводимом ниже примере:
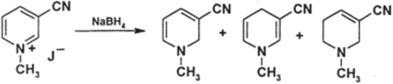
Подбирая восстановители и условия, можно преимущественно получать те или иные продукты; особенно важно получение производных 1,4- дигидропиридина, которые перспективны в фармакологическом отношении, а также могут служить моделями дыхательного кофермента NAD-H. Один из восстановителей, приводящих к таким производным, — гидросульфит натрия.
VI. Таутомерия гидроксии аминопиридинов.
Для производных пиридина, содержащих в положениях 2 и 4 гидроксиили аминогруппы (а также и меркаптогруппу), возможна таутомерия:
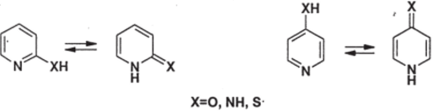
х=о, nh, s.
Для 2- и 4- гидроксипиридинов (Х=Ю) таутомерное равновесие в растворах сильно сдвинуто вправо — в сторону карбонильных форм, называемых, соответственно, 2- и 4- пиридонамщ в газовой фазе, напротив, преобладают гидрокси-формы. Для 2- и 4-аминопиридинов (X=NH) равновесие сильно сдвинуто влево и в растворах; иминные формы находятся в смеси лишь в незначительных количествах. Таутомерия этого типа еще более, чем для производных пиридина, важна для производных гетероциклических систем пиримидина и пурина, входящих в состав нуклеиновых кислот (см. ниже).