Комплексные соединения в растворах

Записывая в уравнении реакции свободный ион М" +, обычно имеют в виду аква- (или, в общем случае, сольватный) комплекс металла, а введение во внутреннюю координационную сферу лиганда означает замену соответствующего числа молекул растворителя (если, конечно, при это не происходит изменения КЧ центрального атома). Обычно координированные молекулы растворителя (в случае водных растворов… Читать ещё >
Комплексные соединения в растворах (реферат, курсовая, диплом, контрольная)
Систематические исследования устойчивости комплексных соединений, существующих в растворах, начались примерно с 1940 г., когда появились фундаментальные работы Я. Бьсррума, в которых впервые были описаны основные подходы к проблеме констант устойчивости указанных соединений.
Отметим большую роль скандинавских химиков (Я. Бьеррум, Л. Силлен, Г. Шварценбах и др.[1]), особенно в начальный период исследований констант устойчивости, заложивших базу для успешного решения проблем стабильности в растворах. Обширные систематические исследования комплексообразования были поставлены в Англии, США и СССР (Л. А. Чугаев, А. А. Гринберг, И. И. Черняев, К. Б. Яцимирский, А. К. Бабко, В. П. Васильев, И. П. Алимарин, И. В. Тананаев, В. И. Сницын, в последние годы Ю. А. Золотов и др.), где много усилий было затрачено на изучение химии комплексных соединений платиновых и других переходных металлов.
Несколько позже началось систематическое изучение комилексообразования в солевых расплавах, правда, на ином по сравнению с растворным методическом основании. В нашей стране существенный вклад в «расплавную» химию комплексов переходных элементов внесли сотрудники К. Б. Яцимирского, в частности С. В. Волков.
О стабильности координационных соединений в растворах обычно судят по так называемым константам устойчивости.
Устойчивость комплексов выражается константами равновесия реакций образования; их и называют константами устойчивости (константы равновесия реакций диссоциации называют константами нестойкости).
Для комплексных соединений постулируется гипотеза о ступенчатом комплексообразовании хотя наличие отдельных стадий в каждом конкретном случае приходится доказывать, как, впрочем, и равновесность рассматриваемых процессов.
Различают ступенчатые константы Кп (для отдельных п ступеней) и полные константы устойчивости Р".
Обозначения констант устойчивости и их названия в старых пособиях могут не совпадать с принятыми в настоящее время. Я. Бьеррумом[2][3] ступенчатые константы записывались как k", а суммарные (полные) как К". С 1958 г. ступенчатые (индивидуальные) константы образования пишут как К2,KN, а полные (суммарные) константы — как Р, р2,…, PiV.

при постоянных температуре и давлении получаем константу К
Используя закон действующих масс для обратимой химической реакции.

где а, Ь, с, d — стехиометрические коэффициенты; аА, яв, ас и aD — активности исходных веществ, А и В и продуктов реакции С и D), величина которой определяет направление реакции и глубину ее протекания.
При образовании комплекса ML" (где М — комплексообразователь, L — лиганд) в системе сосуществуют соединения, образованию которых отвечают следующие равновесия и соответствующие константы:
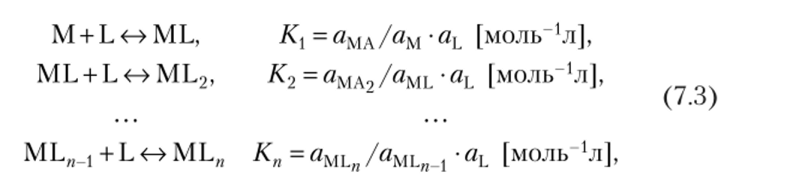
также где aMLx — активности.
Образование комплексов MLW может быть описано с помощью полных констант устойчивости [3″:

Величины Р" и К" связаны между собой уравнением.
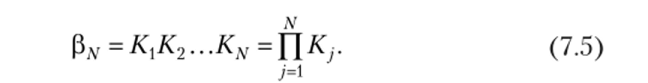
Гипотезу о ступенчатости обычно распространяют и на процессы образования (диссоциации) в случае других классов соединений. Это в первую очередь относится к многоосновным кислотам (кислотно-основные равновесия) и к окислительно-восстановительным системам1.
Различия здесь заключаются в том, что в кислотно-основных равновесиях промежуточные соединения часто присутствуют в ощутимых концентрациях (что во многих случаях позволяет считать ступенчатость доказанным фактом), тогда как в редокссистемах это наблюдается очень редко из-за короткого времени переноса электрона (порядка 10″[4] сек) и частой нестабильности промежуточных соединений.
Промежуточные комплексы, отвечающие разным ступеням процесса образования, можно зафиксировать различными методами. Так, например, для аммиакатов и роданидов меди спектрофотометрически и потенциометрически фиксируются следующие равновесия:

Записывая в уравнении реакции свободный ион М" +, обычно имеют в виду аква- (или, в общем случае, сольватный) комплекс металла, а введение во внутреннюю координационную сферу лиганда означает замену соответствующего числа молекул растворителя (если, конечно, при это не происходит изменения КЧ центрального атома). Обычно координированные молекулы растворителя (в случае водных растворов — координированные молекулы воды) опускают, если в этом нет прямой необходимости. Это оправдывают тем, что растворитель, как правило, присутствует в таком большом избытке по отношению к растворенным веществам, что его активность остается практически постоянной во всех опытах.
Для реакций образования многоядерных комплексов 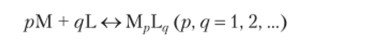 имеют место соответствующие константы.
имеют место соответствующие константы.

Описание процесса комплексообразования, а также и возможных равновесий усложняется в том случае, когда лиганд может занимать несколько координационных мест (например, ЭДТА), атакже может связывать несколько ионов металла или присоединять «протоны» Н+. Здесь различают по крайней мере три типа комплексов общего состава MyH;Z,.
- 1. Одноядерные водородсодержащие комплексы MHZ, MHZ2, MHZ3,…; MH2Z, MH2Z2, MH2Z3;… и т. д.
- 2. Многоядерные комплексы M2Z, M2Z2, M2Z3,…; M3Z, M3Z2, M3Z3;… и т. д.
- 3. Многоядерные водородсодержащис комплексы M2HZ, M2HZ2, M2HZ3, …; M2H2Z, M2H2Z2;… и т. д.
Имеют место три типа ступенчатых констант образования, записанных в концентрационной форме:
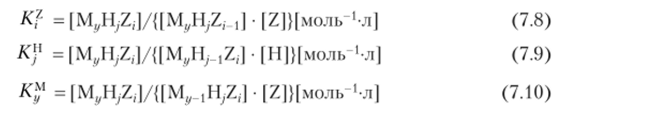
(квадратными скобками показаны концентрации). Каждая из этих констант отвечает процессу присоединения частицы, указанной в верхнем индексе, к соответствующему остатку, причем полные константы образования выглядят следующим образом:
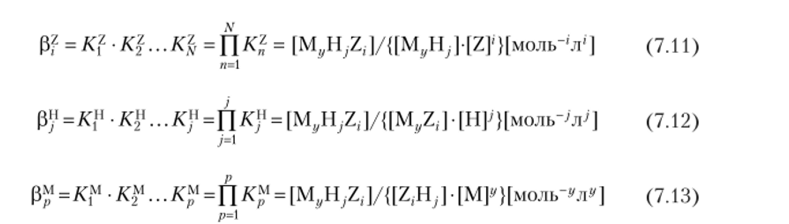
хотя чаще всего рассчитывают полную константу Pm^h^z, •.
- [1] Классические работы: Sillen L. G., // J. Inorg Nucl. Chem. 1958. N 8 (176);Bjemim J., Schwarzenbach G., Sillen L.// Stability Constants of Metal-ion Complexes. Part I (Organic Ligands): Part II (Inorganic Ligands and Solubility Products), Chem. Soc, London, 1957, 1958.
- [2] Г. Шлефер относит выдвижение этой гипотезы к 1902 г. и называет ее «принципом».
- [3] Бъеррум Я. Образование амминов металлов в водном растворе. М.: Иностранная литература, 1961.
- [4] Я. Бьеррум здесь приводил пример обратимого двухступенчатого окисленияорганических аминов.