Прямая и обратная задачи теории химических равновесий в растворе

1] Сведения по константам устойчивости обобщены в базе данных ШРАС SC DB (http://www.acadsoft.co.uk/). Работами А. М. Евсеева и соавт. создан весьма эффективный комплекс вычислительных программ AUTOEQUIL, ориентированныйна математическое описание водно-солевых равновесных систем как известного, таки неизвестного молекулярного состава, до сих пор не имеющий аналогов, но надежности, точности… Читать ещё >
Прямая и обратная задачи теории химических равновесий в растворе (реферат, курсовая, диплом, контрольная)
Растворы и растворные системы в целом, несмотря на их кажущуюся простоту, а тем более в приложении к комплексным соединениям, представляют собой весьма сложные объекты. При смешении реагентов в растворах могут протекать, причем с разной скоростью, разнообразные процессы, физической и химической природы: например, диффузия, тепловая конвекция, а также химические реакции.
Изучением равновесий комплексообразовапия начали заниматься очень давно. Однако «прорывным» этапом здесь явилось введение Я. Бьеррумом (1940;е гг.) так называемой функции образования (обозначается п) и разработка приемов идентификации комплексов, существующих в растворе путем решения системы нелинейных алгебраических уравнений.
Функция образования (п) представляет собой отношение концентраций лиганда, связанного в комплекс, к общей концентрации иона металла-комплексообразователя или среднее число лигандов, связанных с М. Можно показать, что.

Очевидно, что для определения соответствующих констант необходимо решение системы уравнений типа (7.6). В настоящее время составление и решение подобных систем при определении констант устойчивости в случае сложных процессов образования комплексов является довольно тривиальным приемом. Я. Бьерруму и его последователям (И. Ледену, С. Фронсусу, Л. Нейману, Д. Юму, М. Янсену, К. Б. Яцимирскому и др.) в 1940—1960;е гг. приходилось искать упрощенные алгоритмы, прибегать к графическим методам, хотя в некоторых простых случаях (когда в растворе доминирует единственный комплекс, фиксирующийся, например, методом изомолярных серий) удавалось получить решения (в виде соответствующих констант устойчивости) и в аналитическом виде.
Шагом вперед явились работы А. М. Евсеева и соавт. (1988)1, в которых были сформулированы некоторые общие положения теории химических равновесий, в частности, прямая и обратная задачи для равновесий, предложены уникальные алгоритмы расчета констант равновесия и определения числа комплексов, присутствующих в растворах.
Прежде всего, компонентом химической равновесной системы являются вещества, удовлетворяющие условиям независимости и полноты, причем:
- (1) по Гиббсу число компонентов (/?) равно п = т — k> где т — число молекулярных форм, a k — число реакций в системе;
- (2) набор п компонентов составляет базис компонентов;
- (3) существующие в системе молекулярные формы G, для выбранного базиса компонентов могут быть заданы матрицей А, 1-я строка которой определяет химический состав г-й молекулярной формы (Gj) в «единицах» базиса;
- (4) компонентная стехиометрическая матрица А имеет размерность т х пу а ее элементы аУ} определяют состав i-й молекулярной формы G, относительно «единицы» j-того компонента базиса, причем
- (5) элементы а$ — стехиометрические коэффициенты форм Gj относительно компонентов j.
Пример. Для следующей равновесной системы.

т = 5, k = 3, п = 2. В базисе содержатся исходные вещества (А, В) и наборы А, АВ; В, АВ. Все существующие в системе молекулярные формы G, задаются матрицей, которая имеет вид:
Евсеев А. М., Николаева Jl. С., Кирьянов Ю. А. Математическое моделирование химических равновесий // Жури. физ. химии. 1988. Т. 62. Вып. 5. С. 1153—1175. Кирьянов Ю. А. Канд. дисс. М.: МГУ, 1991.
Молекулярная форма. | Gj | A. | В. |
G | A. | ||
g2 | В. | ||
G, | AB. | ||
G< | ab2 | ||
Gs | AB3 |
Далее, равновесный состав системы должен удовлетворять:
• уравнениям закона действующих масс для молекулярных форм из п компонентов.

- (это уравнение представляет собой общую форму указанного закона);
- • максимальному числу линейно-независимых стехиометрических уравнений закона сохранения вещества и заряда

где х и b — векторы пространства компонентов.
«Прямая задача» химических равновесий.
«Прямая задача» формулируется в следующей форме: определить равновесный состав системы (х) по заданному вектору Ь, матрице, А и определенному набору констант реакций Кь …, К" путем решения системы алгебраических уравнений (7.16), (7.17).
Пример. Для двухосновной кислоты H2L, диссоциация которой описывается следующими реакциями:
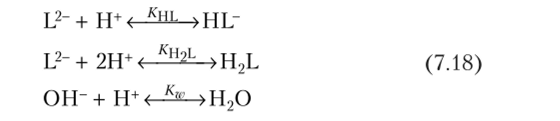
записать компонентную стехиометрическую матрицу А (в предположении, что активность воды постоянна).
Легко показать, что развернутое уравнение массового баланса с учетом закона действующих масс для системы (7.18) записывается в форме.

(xt, x2 — равновесные, a bh b2 — исходные концентрации Н+ и U).
Из указанной «прямой задачи» следует такая же «прямая» задача моделирования этой равновесной системы. При этом имеется в виду решение системы нелинейных алгебраических уравнений (типа 7.17) относительно вектора равновесных концентраций компонентов хт = хи х2 при заданном векторе исходных концентраций Ьт = Ь{, Ь21| и известном наборе параметров системы — констант реакций jfCHL, Kll2L, Kw. Вектор х является решением «прямой» задачи.
Решение (в соответствии с описанным подходом) позволяет достаточно надежно установить равновесный состав системы, по которому может быть рассчитано любое измеряемое свойство системы, являющееся известной функцией состава, например pH = -lg [Н+] = -lg х{.
В настоящее время, когда имеется подходящее компьютерное обеспечение, а математическая теория вопроса широко известна, поиск решений существенно облегчен.
«Обратная задача» химических равновесий А. М. Евсеев и соавт. сформулировали и «обратную задачу» равновесий. Ее актуальность очевидна, гак как (1) все реакции в гомогенных средах осуществляются одновременно и нельзя произвольно выделить для изучения только одну из них; (2) константы равновесия всех возможных стадий a priori неизвестны. Поэтому одновременно анализируются проявления всех параметров реакций К в виде некоторой зависимости наблюдаемой переменной у от контролируемых переменных b и ненаблюдаемых параметров К: 
Так как результаты наблюдений у — случайные величины, измеренные с некоторой погрешностью, то описывается связь средних значений наблюдаемых величин с контролируемыми переменными. Одновременно были разработаны и соответствующие математические модели и приемы, позволяющие определить константы равновесия, что при решении обратной задачи трудно разделить.
Математическая модель процесса представляется следующим образом: 
где Е[у/Ь — математическое ожидание измеряемой величины в точке Ь' = ||Ьь …, Ьп из области допустимых переменных В, b е В a Rn; Rn — евклидово пространство размерности п D[y/b дисперсия случайной величины у в точке Ь К — вектор неизвестных параметров модели К7 = К^У…, Кп; г (К, Ь) — известная функция векторов К и 6, причем независимые переменные b считаются определенными достаточно точно.
Система уравнений в пространстве химических потенциалов компонентов Uj (при V, = Vp i, j = 1, …, п) представляется следующим образом:

Для гомогенных химических равновесий в водных растворах в качестве измеряемой величины удобно выбрать pH системы: у = -lg[H~]. Тогда F (u, b) = -2,3и2у и2 = 1п[Н+]. Если механизм химического равновесия известен, т. е. матрица Л и функция F (u, b) заданы, то задача сводится к определению оценок констант равновесий К по значениям наблюдаемого свойства системы г/, в экспериментальных точках b} i = 1,N.
Обратная задача заключается в расчете констант равновесий модели (7.23) по значениям зависимой переменной у}, измеренным в N экспериментальных точках вектора bv полагая, что вид стехиометрической матрицы, А и функция связи F (w, Ь) известны.
Решение задачи проводится статистическими методами, включая нелинейный метод наименьших квадратов с учетом установленных критериев, опираясь на которые можно судить о вероятности приближения к «истинным» значениям параметров при N —> °°.
В настоящее время известно много расчетных приемов и математических программ, пригодных для расчета констант устойчивости комплексных соединений. Впервые подобная программа была составлена Л. Силленом, а в дальнейшем был разработай целый ряд достаточно эффективных вычислительных программ расчета равновесий. Модификация программ проводилась параллельно с разработкой способов решения соответствующих так называемых экстремальных задач (от приемов линеаризации, аппроксимации, интерполяции минимизируемой функции до сложных вычислительных методов этой функции, включая итерационные приемы достижения ее минимума)[1].
- [1] Сведения по константам устойчивости обобщены в базе данных ШРАС SC DB (http://www.acadsoft.co.uk/). Работами А. М. Евсеева и соавт. создан весьма эффективный комплекс вычислительных программ AUTOEQUIL, ориентированныйна математическое описание водно-солевых равновесных систем как известного, таки неизвестного молекулярного состава, до сих пор не имеющий аналогов, но надежности, точности и достоверности. Пример расчета величин р дастся на с. 654.