Соединения с водородом

В диборане осуществляются две такие системы связей: В|—Н|—В2 и В,—Н2—В2. Кроме того, каждый атом бора образует еще две обычные двухцентровые двухэлектронные локализованные связи. Поэтому в каждой из трехцентровых связей участвуют два электрона — один от атома бора (В,), другой от «мостикового» атома водорода (Н|) — и вакантная орбиталь второго атома бора (В2). Оба электрона располагаются на самой… Читать ещё >
Соединения с водородом (реферат, курсовая, диплом, контрольная)
Как и в предыдущих группах, прочность связи элементов III группы с водородом уменьшается сверху вниз. Соединения состава ЭНз известны лишь для бора и алюминия. Характер связи в этих соединениях и их свойства определяются наличием в молекулах вакантной орбитали на центральных атомах.
Электроотрицательность бора еще достаточно велика (2,01), и связь В-Н фактически ковалентна. При наличии трех связей и четырех орбиталей атом бора в ВН3 координационно-ненасьпцен и молекула ВН3 легко присоединяет частицы, имеющие активные неподеленные пары, например молекулу аммиака, образуя достаточно прочные молекулярные соединения, в которых ковалентная связь между исходными молекулами осуществляется за счет классического донорно-акцепторного взаимодействия:
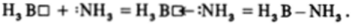
Влияние координационной ненасыщенности столь велико, что при отсутствии соответствующих партнеров-до, но ров молекулы гидридов элементов III группы полимеризуются. Гидрид алюминия существует в виде твердого полимера (А1Н3)*, а бор, подобно углероду, образует многочисленные индивидуальные соединения — бораны.
Существование всех этих соединений обусловлено наличием в них трехцентровых двухэлектронных связей. Даже если Вы, читатель, помните, что это значит, просмотрите еще раз раздел 4.7, а еще лучше — прочитайте его внимательно.
Подобно тому как в молекулах ВеН2 или XeF2 в методе МО образование связи можно считать обусловленным трехцентровым взаимодействием, так и в простейшей полимерной молекуле В2Н6 характер связи проще всего понять именно с этих позиций.
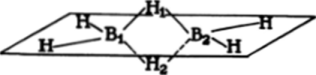
и участвуют в трехцентровых взаимодействиях В—Н-В, возникающих в результате перекрывания двух sp2-гибридных орбиталей двух атомов В молекуле диборана два атома водорода расположены между атомами бора бора и j-орбитали атома водорода. Как и в случаях ВеН2 и XeF2, из трех АО возникает три МО — связывающая, разрыхляющая и несвязывающая.
В диборане осуществляются две такие системы связей: В|—Н|—В2 и В,—Н2—В2. Кроме того, каждый атом бора образует еще две обычные двухцентровые двухэлектронные локализованные связи. Поэтому в каждой из трехцентровых связей участвуют два электрона — один от атома бора (В,), другой от «мостикового» атома водорода (Н|) — и вакантная орбиталь второго атома бора (В2). Оба электрона располагаются на самой низкой, связывающей орбитали, а две другие МО остаются пустыми. Трехцентровая двухэлектронная связь менее прочна, чем двухцентровые двухэлектронные связи, и диборан при нагревании легко диссоциирует: 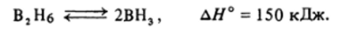
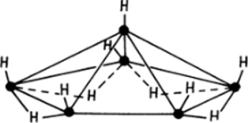
Помимо диборана существует большое число более сложных бороводородов. Наиболее устойчивыми при обычных условиях являются В4Н|0, В6Н10, В10Н14. Все они получаются в смеси с ВаН4 при действии фосфорной кислоты на борид магния MgBj. Кроме трехцентровых связей В-Н-В в сложных боранах реализуются трехцентровые связи В-В-В и двухцентровые В-В. Строение многих из этих соединений отвечает как бы фрагментам икосаэдра В,а, в котором часть атомов бора удалена, а оставшиеся связи насыщаются атомами водорода (рис. 25.2).
В кристаллическом гидриде алюминия — алане — трехцентровые связи образуются с участием не только 5- и р-, но и вакантных 3dорбиталей. В результате осуществляется sp3d2-гибридизация, координационное число атомов алюминия возрастает до шести, каждый атом участвует в образовании шести трехцентровых связей и образуется объемная полимерная структура.
Термическая устойчивость гидрида алюминия невелика, и выше % 100 ЪС он необратимо разлагается на простые вещества. Гидриды более тяжелых элементов в чистом виде не получены. Очевидно, что локализованные двухцентровые до, но рно-акцепторные связи между атомами элементов III группы и какими-либо донорными молекулами прочнее, чем трехцентровые двухэлектронные связи, и поэтому гидриды ЭН3 охотно присоединяют донорные частицы, например молекулы NH3, N (CH3)3, (С2Н5)20 и др. Наиболее важными являются продукты присоединения иона Н". Так, в эфирных или других неводных растворах легко идет реакция:
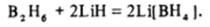
Образующийся тетрагидридоборат (Ш) лития — боронат лития — твердое кристаллическое вещество, имеющее ионное строение Li* [ВН4]. По происхождению и поведению вещества, содержащие ионы ВЬЦ, в известной мере подобны солям аммония:
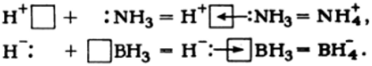
Рис. 25.2. Структура борана ВвН10, которую можно рассматривать как часть икосаэдра из атомов бора.
Гидриды элементов третьей группы — весьма реакционноспособные вещества, при обычных условиях бурно реагирующие с водой, галогенами, часто самовозгорающиеся на воздухе:
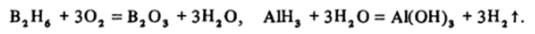
Подобным же образом ведут себя и соединения МА1Н4. Например, они энергично разлагаются водой.
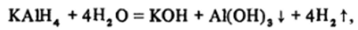
являются сильными восстановителями и широко используются при синтезе различных органических соединений в неводных средах.
К бинарным гидридам бора примыкают и более сложные соединения с водородом, содержащие одновременно бор и углерод: карбораны, бор и азот — азобораны.
Введение
атомов углерода в бороводородные скелеты повышает их устойчивость. Так, замещение двух атомов бора в икосаэдрическом скелете резко увеличивает термическую устойчивость соединения В|0СаН12 (до **600°С). На основе карборанов синтезированы некоторые полимеры, обладающие денными свойствами. Химия гидридов бора и их производных — быстро развивающаяся область химии.
Система из атомов BN изоэлектронна системе С-С. В частности, хорошо изучено соединение боразол (аналог бензола) — ароматическое кольцо с чередующимися атомами бора и азота. Можно предполагать, что химия борорганических соединений столь же разнообразна, как и химия кремнийорганических производных, и здесь нас ждет получение многих новых веществ с интересными потребительскими свойствами.