Водород.
Неорганическая химия

Для водорода наиболее характерны ковалентные соединения с обобществленной электронной парой и а-связыо. Преимущественно ковалентные a-связи водород образует со всеми p-элементами, в том числе с важнейшими биогенными элементами. Эти связи характеризуются значительной прочностью и заметной полярностью, которая может быть различной по значению и даже знаку в зависимости от электроотрицательности… Читать ещё >
Водород. Неорганическая химия (реферат, курсовая, диплом, контрольная)
В результате успешного освоения материала этой главы студент должен:
знать
- • особенности строения атома водорода, физических и химических свойств этого элемента;
- • химические свойства бинарных соединений водорода;
- • природу водородной связи и ее значение в природе;
- • строение и свойства молекулы воды, структуру льда и жидкой воды, химические свойства воды;
уметь
• составлять уравнения реакций с участием важнейших соединений водорода;
владеть
• представлениями о значении водорода как наиболее распространенного элемента Вселенной; о роли водорода в биосфере Земли; о роли воды и гидросферы в формировании климата Земли и в миграции химических элементов.
Важнейшие свойства водорода
Водород — важнейший биогенный элемент, его физические и химические свойства уникальны. Особую роль в формировании климата Земли, в разрушении первичных минералов и возникновении вторичных, в миграции биогенных элементов, в обмене веществ у растений и животных играет самое распространенное соединение водорода — вода. Поэтому водороду и его соединениям посвящена отдельная глава.
Водород в природе. Водород — самый распространенный элемент Вселенной. Больше половины массы многих космических объектов (газовых облаков, звезд, в том числе Солнца) приходится на долю водорода.
Распространенность же водорода на Земле, включая атмосферу, гидросферу и литосферу, составляет только 0,88% (по массе). Но атомная масса водорода очень мала, и это кажущееся небольшим содержание означает, что из каждых 100 атомов па Земле 17 являются атомами водорода.
В свободном состоянии вблизи поверхности Земли водород встречается крайне редко. В смеси с другими газами он выделяется при извержении вулканов, в небольших количествах присутствует в продуктах разложения органических остатков и в виде включений в калийных рудах.
Большая часть водорода в обычных условиях находится в виде соединений: это свободная вода, кристаллизационная вода минералов, метан и углеводороды нефти, разнообразные гидроксиды, образующие многие минералы, органические вещества биомассы растений и животных, органическое вещество почвы.
Своеобразие химических свойств водорода. В основном, невозбужденном, состоянии электронная конфигурация атома водорода изображается электронно-структурной формулой:
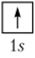
Ядром атома водорода является нуклон — протон, а электронная оболочка образована одним-единственным электроном. Между ядром и валентным электроном нет ослабляющих их взаимодействие (экранирующих) электронных оболочек, радиус атома Н невелик, поэтому для отрыва электрона от атома водорода нужна значительная затрата энергии. Энергия ионизации водорода равна 1310 кДж/моль. Она намного больше первых энергий ионизации атомов щелочных металлов (для лития 529 кДж/моль) и близка к первым энергиям ионизации атомов галогенов (для фтора 1682 кДж/моль, для хлора 1255 кДж/моль).
Теряя электрон, атом водорода превращается в катион водорода Н+, который имеет вакантную Lv-орбиталь:
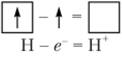
Катион водорода представляет собой не что иное, как нуклон — протон. Малые размеры протона и его сильное электростатическое поле являются причинами того, что катион Н+ очень активно взаимодействует с электронными облаками окружающих его атомов. Поэтому в веществе катион Н+ в свободном виде не существует, он всегда связан с другими атомами или молекулами.
Для достройки наружного электронного слоя до конфигурации благородного газа гелия (Is2) атому водорода не хватает одного электрона. При присоединении этого электрона образуется отрицательно заряженный гидрид-ион Н":
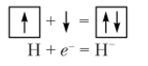
Выделяющаяся при этом энергия сродства к электрону не слишком велика (67,4 кДж/моль).
Таким образом, энергия ионизации атома Н велика, а сродство к электрону мало. Поэтому электроотрицательность водорода имеет значение 2,2, среднее между электроотрицательностями галогенов и щелочных металлов (см. табл. 10.2). Сочетание этих свойств атома водорода порождает особенности его связей и химического поведения его соединений.
Для водорода наиболее характерны ковалентные соединения с обобществленной электронной парой и а-связыо. Преимущественно ковалентные a-связи водород образует со всеми p-элементами, в том числе с важнейшими биогенными элементами. Эти связи характеризуются значительной прочностью и заметной полярностью, которая может быть различной по значению и даже знаку в зависимости от электроотрицательности элемента, образующего связь с водородом:
Связь Н-Н С-Н N-H О-Н F-H Si-H Р-Н S-H С1-Н Энергия 436 413 391 463 563 323 322 339 432.
связи, кДж/моль Заряд 0 +0,065 +0,15 +0,33 +0,42 -0,01 +0,05 +0,10 +0,18.
атома Н В целом можно сказать, что водород образует связи следующих типов: почти неполярные ковалентные (Si—Н, С—Н, Р—Н), полярные с положительным зарядом атома водорода (F—Н, О—Н, N—Н), ионные с участием аниона Н", водородные связи, мостиковые трехцентровые связи (например, в соединении В2Н6, см. рис. 11.20).
Изотопы водорода. В природе наряду с описанным уже атомом Н, ядро которого представляет собой протон, встречаются стабильный изотоп 2Н и радиоактивный изотоп 3Н (табл. 14.1). В атомном ядре изотопа 2Н наряду с протоном имеется еще один нуклон — нейтрон. Масса ядра этого изотопа водорода в два раза больше массы ядра обычного атома Природные изотопы водорода.
Изотоп. | Число протонов в ядро. | Число нейтронов в ядре. | Атомная масса, а. е. м. | Содержание в природной смеси, %. |
Протай*Н. | 1,7 826. | 99,9844. | ||
Дейтерий 2Н или D. | 2,14 083. | 0,0156. | ||
Тритий 3Н или Т. | 3,16 026. |
водорода. Такой большой разницы в массах ядер изотопов нет больше ни у одного элемента периодической системы. Учитывая такую значительную разницу в атомных массах, изотопам водорода присвоили собственные наименования и химические символы: легкий изотоп ]П называется протийу в два раза более тяжелый 2Н — дейтерий, его химический символ D. Радиоактивный изотоп водорода 3Н — тритий у его химический символ Т.
Изотопы водорода образуют двухатомные молекулы: Н2, HD, НТ, D2, DT и Т2. Вещества, состоящие из молекул изотопов водорода, в нормальных условиях практически не отличаются от обычного водорода по химическим свойствам, но имеют несколько иные физические и химические свойства при низких температурах. Например, температуры кипения имеют для них следующие значения:
Молекулы Н2 HD НТ Г>2 DT Т2
Тт, К 20,39 22,14 22,92 23,67 24,38 25,04.
Важнейшие соединения дейтерия — тяжелая вода D20 и дейтерид лития 6LiD. Тяжелая вода применяется как замедлитель нейтронов в ядерных реакторах. Дейтерид лития основной компонент заряда водородных бомб. Дейтерий и тритий используют в качестве меченых атомов в научных исследованиях в химии, биологии, физиологии растений и животных, агрохимии и медицине.