Магний и кальций

Сульфаты. В природе сульфат магния MgS04 существует в виде нескольких минералов. Все они содержат кристаллизационную воду, как, например, эпсомит (горькая соль) MgSO/,? 7Н2(). Безводный сульфат магния можно получить из кристаллогидратов при нагревании до 320 °C. С некоторыми солями щелочных металлов MgSO/, образует двойные соли, многие из которых встречаются в природе н представляют собой… Читать ещё >
Магний и кальций (реферат, курсовая, диплом, контрольная)
Металлическое состояние. Магний и кальций — серебристые металлы, существенно более твердые, чем щелочные металлы, но более мягкие и пластичные, чем бериллий. При хранении на воздухе магний сохраняет тусклый металлический блеск, потому что покрывается прочной оксидной пленкой, защищающей его при комнатной температуре от дальнейшего окисления и от взаимодействия с водой. Кальций на воздухе быстро теряет блеск, так как образующийся оксид кальция взаимодействует с парами воды и нс защищает его от окисления. Магний и кальций — сильные восстановители.
Получение. В промышленности магний и кальций получают либо электролизом расплавов обезвоженных хлоридов, либо восстановлением из оксидов при высоких температурах:
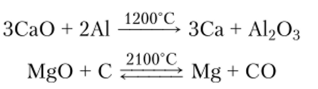
Последняя реакция обратима. Для предотвращения протекания обратной реакции смесь паров магния и оксида углерода^) при выходе из зоны реакции быстро охлаждают инертным газом.
Бинарные соединения. Вследствие высокой химической активности магния и кальция подавляющее большинство их бинарных соединений можно получить прямым синтезом из простых веществ (табл. 16.4). Реакции с участием магния протекают менее интенсивно. Бинарные соединения кальция обладают ионными свойствами, а бинарные соединения магния занимают промежуточное положение между ионными и ковалентными соединениями.
Таблица 16.4
Бинарные соединения магния, кальция и их значения A Gy; 298
(кДж/моль).
MgH2(K). — 36,7. | ||||
MgB2(K). — 100,3. | MgC2(K). — 84,5. | Mg3N2(x). — 401. | MgO (K). — 569. | MgF2(K). — 1071. |
Mg2Si (K). — 76,2. | Mg3P2(K). — 487,5. | MgS (K). — 341. | MgCl2(K). — 592. | |
СаН2(к). — 136. | ||||
СаС2(к). — 67. | Ca3N2(K). — 369. | СаО (к). — 604. | СаГ2(к). — 1176. | |
Ca2Si (K). — 209. | Са3Р2(к). — 543. | CaS (i<). — 477. | СаСЬ (к). — 749. | |
Гидриды. Кальций при нагревании реагирует с водородом с образованием ионного гидрида кальция СаН2. Магний тоже взаимодействует с водородом, но очень медленно даже при высокой температуре и повышенном давлении. При этом образуется гидрид магния MgH2, который по свойствам и природе химической связи занимает промежуточное положение между ионными и ковалентными гидридами. Гидрид кальция устойчив при нагревании. Гидрид магния разлагается при нагревании до 280°С: 
С водой и другими соединениями, способными отщеплять протон, MgH2 реагирует менее энергично, чем СаН2:
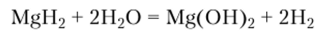
Галогениды. Магний и кальций взаимодействуют с галогенами с образованием галогенидов:
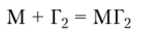
где Г = F, Cl, Br, I. Все галогениды магния и кальция — бесцветные кристаллические вещества.
Фториды магния и кальция — малорастворимые соединения. Их кристаллы нс содержат кристаллизационной воды. Они относятся к числу наиболее тугоплавких и труднолетучих фторидов (табл. 16.5). В парах присутствуют линейные молекулы MgF2 и уголковые молекулы CaF2. В природе фторид кальция образует минерал флюорит (плавиковый шпат), который используют в качестве сырья для получения фтороводорода и элементного фтора.
Таблица 16.5
Свойства фторидов магния и кальция.
Показатель. | MgF2 | CaF2 |
Температура плавления, °С. | ||
Температура кипения, °С. | ||
Растворимость, моль/1000 г Н20. | 2,1−10 3 | 2,1-ИГ4 |
Хлориды, бромиды и иодиды магния и кальция очень хорошо растворимы в воде. Кристаллизуясь из водных растворов при комнатной температуре, они образуют гексагидраты МГ2-6Н20, например СаС12-6Н20. Кристаллогидраты при нагревании теряют воду. Процесс этот происходит в несколько этапов, например обезвоживание гексагидрата хлорида кальция можно изобразить следующей схемой:
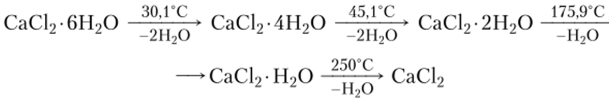
При обезвоживании галогениды частично гидролизуются. Не содержащие кристаллизационной воды галогениды магния и кальция (кроме фторидов) гигроскопичны: поглощают пары воды из воздуха. Безводные галогениды термически устойчивы.
Обезвоженный СаС12 используют для осушки газов и жидкостей. Растворы СаС12 и MgCl2 замерзают при значительно более низких температурах, чем чистая вода; на этом основано использование их в качестве средства против обледенения. Растворы СаС12 используют как лекарство при аллергических заболеваниях, кровотечениях и т. п.
Оксиды. Кальций интенсивно взаимодействует с кислородом при комнатной температуре. При нагревании он сгорает. Магний при обычных условиях защищен от окисления оксидной пленкой. Он сгорает только после ее разрушения при 600 °C. При горении на воздухе наряду с оксидами МО образуются нитриды M3N2. В промышленности MgO и СаО получают прокаливанием карбонатов:
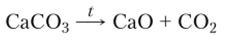
Особо чистые оксиды обоих металлов можно получить при прокаливании нитратов. Оксид магния (жженая магнезия) и оксид кальция (негашеная известь) — тугоплавкие бесцветные кристаллы.
Оксиды магния и кальция — основные оксиды. При взаимодействии их с водой образуются гидроксиды:
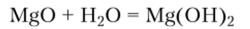
Реагируя с кислотами, MgO и СаО дают соли:
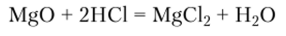
Оксиды магния и кальция находят широкое применение в химической промышленности и строительстве. Оксид магния применяют в медицине для понижения кислотности желудочного сока.
Сульфиды, нитриды, фосфиды, карбиды и силициды.
Эти бинарные соединения магния и кальция при взаимодействии с водой гидролизуются:
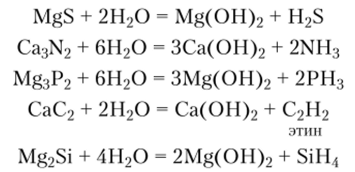
Гидроксиды. Гидроксиды обоих металлов — бесцветные кристаллические вещества, малорастворимые в воде. Гидроксид магния Mg (OH)2 — слабое основание. Гидроксид кальция
Ca (OH)2 — сильное основание лишь по первой ступени диссоциации'.
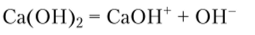
Диссоциация по второй ступени, т. е. диссоциация катиона СаОН+, происходит по механизму слабого электролита:
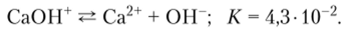
При нагревании гидроксиды магния и кальция разлагаются:
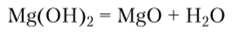
Оба гидроксида взаимодействуют с кислотами и кислотными оксидами.
Соли. Соли щелочноземельных металлов и магния, подобно солям щелочных металлов, бесцветны, если окраска не обусловлена анионами. В отличие от солей щелочных металлов многие соли магния и кальция малорастворимы (табл. 16.6): это фториды и соли с двухи трехзарядными анионами.
Растворимые соли щелочноземельных металлов выделяются из водных растворов почти всегда в виде кристаллогидратов. Многие из них содержат по 6 молекул воды. У других кристаллогидратов число молекул воды иное — 2,4, 8 и даже 12 и может изменяться с температурой.
Таблица 16.6
Растворимость некоторых солей магния и кальция (моль/1000 г Н20) при 25 °C.
Соли. | Растворимость солей. | Соли. | Растворимость солей. | ||
Mg2+ | Са2+ | Mg2+ | Са2+ | ||
Фториды. mf2 | О со. | 2,2 Ю-4 | Г идрокарбонаты М (11С03)2 | 0,9. | 2,7−10 2 |
Хлориды МС12 | 5,81. | 7,93. | Карбонаты МСОз. | 4,5−10 3 | 7,1−10 5 |
Бромиды МВг2 | 5,61. | 7,65. | Сульфаты. mso4 | 3,10. | 1,2−10 2 |
Йодиды М12 | 5,25. | 7,35. | Дигидрофосфаты М (П2Р04)2 | 0,6. | 0,6. |
Нитраты М (Ш3)2 | 2,93. | 8,42. | Гидрофосфаты мнро4 | 9,2 -10 4 | 7,9 -10 4 |
Перхлораты М (СЮ4)2 | 4,48. | 7,89. | Фосфаты М3(Р04)2 | 5,9−10 4 | 4,0 -10 6 |
Карбонаты. В природе карбонат кальция образует два минерала, различающихся структурами кристаллических решеток: широко распространенный кальцит и реже встречающийся арагонит. Оба минерала не содержат кристаллизационной воды. Карбонат магния в отличие от СаСОз, кроме безводного минерала магнезита MgC03, образует минералы, в состав которых входит кристаллизационная вода.лансфордит MgC03 -5H20 и несквегонит MgC03−3H20. Безводные карбонаты магния и кальция — малорастворимые вещества, причем растворимость СаСОз существенно меньше растворимости MgCC>3. Если вода содержит углекислый газ, обе соли растворяются с образованием гидрокарбонатов, существующих только в водных растворах:
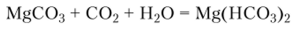
При прокаливании MgC03 и СаСОз разлагаются с образованием оксида соответствующего металла и оксида углерода (1У).
Нитраты. Эти соли магния и кальция хорошо растворимы. При обычных условиях они выделяются из растворов в виде кристаллогидратов Mg (N03)2 • 6Н20 и Са (Ы0з)2-4Н20. Безводные соли при нагревании разлагаются с выделением кислорода, оксида азота (1У) и оксида соответствующего металла:
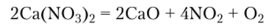
Сульфаты. В природе сульфат магния MgS04 существует в виде нескольких минералов. Все они содержат кристаллизационную воду, как, например, эпсомит (горькая соль) MgSO/,? 7Н2(). Безводный сульфат магния можно получить из кристаллогидратов при нагревании до 320 °C. С некоторыми солями щелочных металлов MgSO/, образует двойные соли, многие из которых встречаются в природе н представляют собой минералы, например карналлит и каинит. Сульфатион SO 1~ и катион Mg2+ образуют комплексное соединение, поэтому сульфат магния хорошо растворяется в воде.
Сульфат кальция в отличие от сульфата магния образует в природе не только кристаллогидрат CaS04-2H20 (гипс), но и не содержащий кристаллизационной воды минерал ангидрит. При нагревании до 120 °C гипс частично теряет воду и превращается в 2CaS04-H20. Кашица, приготовленная из 2CaS04H20 и воды, быстро затвердевает в результате протекания реакции 
Сульфат кальция — малорастворимая соль.
При температурах порядка 1000 °C безводные сульфаты обоих металлов разлагаются:
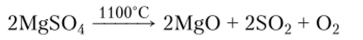
Фосфаты. В сельском хозяйстве в качестве фосфорных удобрений используют фосфаты кальция: ортофосфат Са3(Р04)2, гидроортофосфат СаНР04, дигидроортофосфат Са (Н2Р04)2. В этом ряду увеличивается растворимость солей. Кислые соли могут образовывать кристаллогидраты: СаНР04 • 2Н20 и Са (Н2Р04)2 • Н20.
Фосфаты магния не находят такого широкого применения, как фосфаты кальция, вследствие дороговизны их производства. В небольших количествах в качестве удобрения используют малорастворимый ортофосфат магния-аммония MgNH4P04 • 6Н20, который содержит сразу три питательных элемента: азот, фосфор и магний.
Жесткость воды. Это свойство природной воды, обусловленное присутствием в ней катионов Са2+ и Mg2" .
При использовании жесткой воды в системах горячего водоснабжения образуются осадки нерастворимых солей кальция и магния (накипь). При мойке и стирке в жесткой воде резко возрастает расход моющих средств и мыла, так как они расходуются на образование нерастворимых солей катьция и магния.
Жесткость воды измеряется в миллимолях эквивалента палитр (ммоль/л). Суммарная молярная концентрация эквивалентов катионов Са2+ и Mg2+ (ммоль/л) называется общей жесткостью. Различают воду мягкую (жесткость < 2 ммоль/л), средней жесткости (жесткость 2—10 ммоль/л) и жесткую (жесткость >10 ммоль/л). Общая жесткость складывается из карбонатной (временной) и некарбонатной (постоянной). Карбонатная жесткость обусловлена присутствием в воде растворимых гидрокарбопатов Са (НС03)2 и Mg (HCO<3)2. Ее можно устранить кипячением воды. При этом растворимые гидрокарбонаты разлагаются, а кальций и магний выпадают в осадок в виде нерастворимых солей:
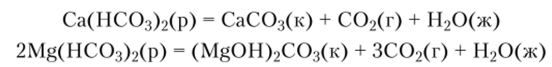
Некарбонатная жесткость вызвана наличием сульфатов, хлоридов и нитратов кальция и магния.
Общую жесткость воды обычно устраняют либо использованием реагентов, вызывающих осаждение катионов Са2+
и Mg2+ в виде нерастворимых солей, либо ионным обменом этих катионов на Na+ или Н+ на катионитах.
Для умягчения воды чаще других реагентов используют Са (ОН)2 и №2СОз. При использовании Са (ОН)2 увеличивается pH воды и происходит нейтрализация гидрокарбонатиона НСО3:
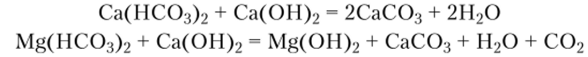
При использовании карбоната натрия (соды) происходят реакции:
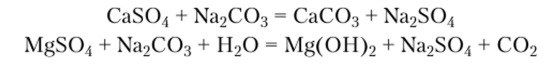
При умягчении воды методом ионного обмена используют синтетические катиониты, полимерный каркас которых несет активные сульфогруины —SO3H. При пропускании жесткой воды через слой такого катионита в Н-форме (RH2) катионы Н+ замещаются катионами Са2+ и Mg2+:
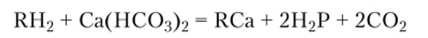
Часто используют катиониты в натриевой форме RNa2, т. е. смолы, в которых активные группы вместо катионов Н+ содержат Na+:
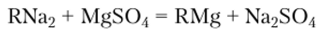
В результате этих реакций катионы Са2+ и Mg2' удаляются из раствора, а их место занимают не вызывающие жесткость воды Na+ или Н+.