Гидратированные катионы, комплексные соединения, ионный обмен

Иониты состоят из органического или неорганического каркаса (матрицы), несущего положительный или отрицательный заряд, и подвижных ионов противоположного знака (противоионов). Сумма зарядов противоионов равна заряду каркаса, поэтому ионит в целом всегда электронсйтралсн. Противоионы ионита подвижны, они могут замещаться ионами из раствора электролита. Если обменивающиеся ионы — катионы, то ионит… Читать ещё >
Гидратированные катионы, комплексные соединения, ионный обмен (реферат, курсовая, диплом, контрольная)
Гидратированные катионы. Важнейшей формой существования щелочных металлов в природе являются гидратированные катионы. Именно в виде гидратированных катионов щелочные металлы присутствуют в гидросфере и биосфере и участвуют в большом количестве химических реакций.
Катионы щелочных металлов имеют электронную конфигурацию благородных газов. Их внешние электронные оболочки создают плотное электронное облако, которое слабо поляризуется внешним электрическим полем. Эта особенность электронного строения катионов элементов 1-й группы позволяет рассматривать их при образовании химических связей в виде идеальных сфер — шаров.
Заряд катионов щелочных металлов мал (+1), а размеры велики: в каждом периоде самый крупный катион — это катион щелочного металла. Вследствие этого ион-дипольное взаимодействие катионов щелочных металлов с полярными молекулами воды не приводит к образованию прочных первичных гидратных оболочек. Ближайшее окружение катионов Li+, Na+, К+ состоит из различного числа молекул воды, находящихся в непосредственном контакте с катионом. Это число зависит и от размеров катиона, и от активности свободной воды в растворе. Размеры гидратной оболочки характеризуются радиусом гидратированного катиона. Он уменьшается от Li+ к Cs+, т. е. самый маленький катион Li+ имеет самую крупную гидратную оболочку и самые большие энтальпию и свободную энергию гидратации (табл. 15.6).
Молекулы воды гидратных оболочек слабо удерживаются катионами щелочных металлов. Абсолютное значение, А #°, приходящееся на ион-дипольное взаимодействие с одной молекулой воды, мало и составляет у самого маленького катиона Li+ примерно -147 кДж/моль. Поэтому молекулы воды гидратных оболочек катионов щелочных металлов очень быстро меняются местами со свободными молекулами воды из объема раствора.
Среднее время жизни молекулы воды в гидратной оболочке составляет миллиардные доли секунды (см. табл. 15.6) и уменьшается с ростом радиуса негидратированного катиона (рис. 15.2).
Таблица 15.6
Характеристики гидратированных катионов щелочных металлов.
Свойства. | LC. | Na+ | К*. | Rb" . | Cs+ |
Ионный радиус, пм. | |||||
Число молекул воды, находящихся в контакте с катионом, пм. | 4; 6. | 6; 8. | |||
Радиус гидратированного катиона, нм. | |||||
Среднее время жизни молекулы воды в гидратной оболочке катиона, с. | 2−10 9 | 1 10 9 | 8−10 10 | 5 10 10 | 310 10 |
Дегидратации. кДж/МОЛЬ. | — 587. | — 473. | — 389. | — 364. | — 340. |
Дегидратации. кДж/мОЛЬ. | — 548. | — 447. | — 371. | — 348. | — 329. |
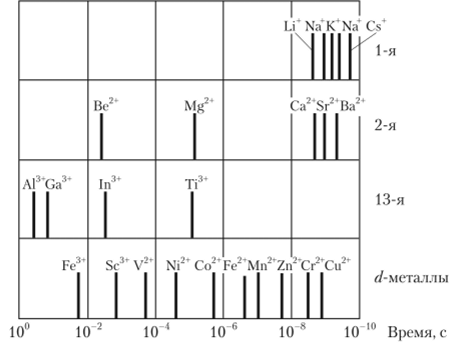
Рис. 15.2. Среднее время жизни молекул воды в первичной гндратной оболочке катионов
При увеличении концентрации раствора уменьшается число молекул воды, находящихся в контакте с катионом; в насыщенном растворе КОН (21,01 моль/1000 г Н20) на каждый катион К+ приходится около двух молекул воды, а в насыщенном растворе NaOH (28,25 моль/1000 г Н20) на каждый катион Na' — около двух молекул воды.
Таким образом, гидратированные катионы щелочных металлов имеют лабильные (неустойчивые) гидратные оболочки с ион-дипольной природой взаимодействия и переменным составом.
Кристаллогидраты. Малая прочность гидратных оболочек приводит к тому, что при кристаллизации из растворов катионы щелочных металлов могут терять гидратные молекулы воды. Склонность к образованию кристаллогидратов уменьшается от Li+ к Cs+. Это обусловлено уменьшением энергии ион-дипольного взаимодействия с молекулами воды по мере роста радиуса катиона.
Практически важными кристаллогидратами являются Na2C03— 10Н2О, Na2SO4-10H2O, NaH2P04-2H20, Na2HP04— • 121120, Na3P04— 12П20. Большое число молекул кристаллизационной воды в ортои гидрофосфатах натрия сильно увеличивает массу этих солей и затрудняет их использование. В противоположность солям натрия практически все соли калия, в том числе К2С03, K2S04, КН2Р04, К2НР04 и К3Р04, кристаллизационной воды не содержат. Это создает существенное удобство их применения как удобрений и реагентов.
Комплексные соединения. Катионы щелочных металлов имеют малые заряды и большие радиусы, поэтому комплексные соединения, которые они образуют с неорганическими лигандами, неустойчивы в водных растворах. Более прочные комплексы образуют катионы Li+, Na+ и К+ с хелатообразующими и макроциклическими лигандами (табл. 15.7).
Среди макроцикл ических лигандов выделяют лигандыиопофоры, которые способны переносить катионы через биологические мембраны. Иопофоры обладают избирательным действием (селективностью). Например, антибиотик валиномицин образует прочные комплексы только с катионами калия.
Селективность иоиофоров играет большую роль в жизнедеятельности клетки. Наличие в клеточной мембране ионофора, образующего комплексные соединения преимущественно с одним из катионов, является условием проникновения этого катиона внутрь клетки. В результате концентрация этого катиона в клетке может соответствовать ее физиологическим потребностям.
Ионный обмен. Это один из важнейших процессов, определяющих поведение катионов щелочных металлов в клетках, тканях животных и растений, а также в почвах.
Ионный обмен — это обратимая химическая реакция обмена ионами между твердым веществом — ионообменником (ионитом) и раствором электролита.
Таблица 15.7
Значение lg^-ст комплексных соединений щелочных металлов при 25 °C.
Лиганд. | Характеристика лиганда. | lg Куст ДЛЯ. | ||
Li+ | Na+ | К" . | ||
Сульфат-ион S04 | 1 или 2 донорных атома О. | 0,64. | 0,71. | 0,96. |
Пирофосфат-ион Р207г | 2 или 3 донорных атома О. | 3,1. | 2,3. | 1,5. |
Цитрат-ион НОС (СН2)2(СООО)з~. | 3 донорных атома О, 2 хелатных цикла. | 0,83. | 0,70. | 0,59. |
Этилендиаминтетра; ацетат-ион. |
| 2,85. | 1,79. | 0,96. |
18-Краун-6. | 6 донорных атомов О, 6 хелатных циклов. | —. | 0,30. | 2,06. |
Валииомидии (в метаноле). | Сложная координация. | 1,28. | 0,67. | 4,90. |
Иониты состоят из органического или неорганического каркаса (матрицы), несущего положительный или отрицательный заряд, и подвижных ионов противоположного знака (противоионов). Сумма зарядов противоионов равна заряду каркаса, поэтому ионит в целом всегда электронсйтралсн. Противоионы ионита подвижны, они могут замещаться ионами из раствора электролита. Если обменивающиеся ионы — катионы, то ионит называют катионитом. Каркас катионита несет отрицательный заряд. Если обменивающиеся ионы — анионы, то ионит называют анионитом. Каркас анионита несет положительный заряд.
Различают природные иониты (цеолиты, многие глинистые минералы, целлюлоза, древесина, органическое вещество почвы, торф) и синтетические иониты (ионообменные смолы, синтетические цеолиты).
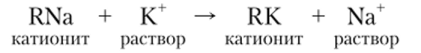
Ионный обмен является эквивалентным. Если, например, п моль эквивалентов катиона Na+ переходит из ионита RNa в раствор, то п моль эквивалента катиона К+ переходит из раствора в ионит:
Равновесие ионного обмена описывается законом действующих масс:
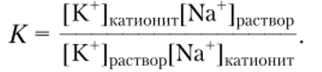
С помощью константы равновесия К легко определить, в какую сторону смещено равновесие ионного обмена, т. е. определить, какой из ионов (Na+ или К+) предпочтительно удерживается катионитом. Установлено, что большинство природных и синтетических катионитов предпочтительно поглощают катионы с наибольшим ионным радиусом и большим зарядом. Другими словами, в ряду.
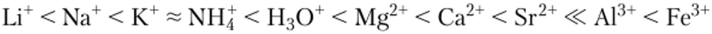
сродство катиона к каркасу катионита возрастает. Прочнее всех катиониты удерживают катионы Fe3+ и слабее других — катионы Li+.
Ионный обмен широко используют в технике, например для очистки лекарственных препаратов, сахара, для выделения ценных металлов, рекуперации сточных вод, получения деионизированной воды, не содержащей минеральных примесей, и т. п.
Особенно велика роль ионного обмена в процессах минерального питания растений.