Хром.
Химия

Оксиды. Хром образует несколько оксидов: СгО, Сг304, Сг7Оэ, СгО" СЮ3 и др. Монооксид хрома получают прямым синтезом из простых веществ. Реакция Сг (тв) + 1/202(г) = СгО (тв) приводит к образованию прочных полярных связей хром — кислород и сопровождаются выделением тепла, но идет с существенным понижением энтропии (AS^ ~ -100 Дж/мольК), поэтому с точки зрения термодинамики протеканию этой реакций… Читать ещё >
Хром. Химия (реферат, курсовая, диплом, контрольная)
Хром находится в 6-й группе, в его электронной оболочке на два электрона больше, чем у титана. В основном состоянии атом хрома содержит две полузаполненные оболочки: [ArJSrfMs1 с шестью неспаренными электронами. Благодаря наличию шести валентных электронов и не очень высокой электроотрицательности хрома (1,6) химия его очень богата и разнообразна: он проявляет все степени окисления от -2 до +6. Как и в случае титана, самые низкие степени окисления (-2, -1, 0 и +1) проявляются только в комплексных соединениях с тг-акцепторыми лигандами, например в карбониле Сг (СО)6. Наиболее характерна для хрома степень окисления +3 и, соответственно, электронная конфигурация иона d3. В природе хром встречается в основном в виде соединений Сг (Ш), например хромистого железняка Fe0Cr203, правда, на Урале встречается красная свинцовая руда РЬСг04, в которой хром находится в степени окисления +6, характеризующейся выраженными окислительными свойствами.
Простое вещество. Хром представляет собой голубовато-серебристый металл, который легко растворяется в обычных кислотах (разбавленных соляной, серной и др.), но пассивируется кислотами-окислителями типа азотной и царской водки. При растворении металлический хром обычно окисляется до характерного для него состояния Сг (Ш).
Получают хром методами гидрометаллургии — электролизом концентрированных растворов СгОэ или Cr2(S04)3 в серной кислоте либо методами пирометаллургии — восстановлением Сг203 алюминием в вакууме или в атмосфере водорода. При необходимости хром рафинируют знакомым нам иодидным методом.
Хром широко используется как компонент специальных сталей и сплавов и применяется для хромирования металлических изделий — электролитического нанесения декоративных и коррозионностойких покрытий.
Оксиды. Хром образует несколько оксидов: СгО, Сг304, Сг7Оэ, СгО" СЮ3 и др. Монооксид хрома получают прямым синтезом из простых веществ. Реакция Сг (тв) + 1/202(г) = СгО (тв) приводит к образованию прочных полярных связей хром — кислород и сопровождаются выделением тепла, но идет с существенным понижением энтропии (AS^ ~ -100 Дж/мольК), поэтому с точки зрения термодинамики протеканию этой реакций (и аналогичных реакций с участием других металлов) с большим выходом благоприятствует низкая температура. Однако для преодоления кинетических трудностей требуется высокая температура. Выход из этой противоречивой ситуации находят на пути снижения энергии активации с учетом индивидуальных особенностей каждой реагирующей системы. Для получения СгО хром применяют не в чистом виде, а в виде амальгамы — раствора (жидкого сплава) в ртути, и окисление проводят на воздухе без нагревания.
Зеленый оксид хрома (Ш) получается при горении металла в кислороде. Практически его удобно получать восстановлением соединений хрома (У1) — хроматов типа К2Сг04 или бихроматов типа К2Сг207 углем или серой, например: 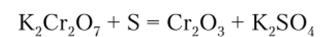
Оксид хрома (Ш) проявляет амфотерные свойства: он ограниченно растворяется в кислотах и щелочах. При растворении в кислотах образовуются ионы [Сг (Н20)6]3+, которые легко гидролизуются (радиус свободного иона Сг3+ равен радиусу Ti4+) с образованием ионов [Сг (Н70)50П]2+. При дальнейшем увеличении pH идут глубокий гидролиз и полимеризация, и в итоге образуется гидратированный оксид Сг203 яН20, который легко растворяется в минеральных кислотах и растворах щелочей. В последнем случае образовуются хромиты, в которых хром (Ш) входит в состав анионов [Сг (Н20)(ОН)5]2 и [Сг (ОН)6]3_. Кристаллические хромиты имеют состав МСг (ОН)4 и M7Cr (OH)5, М = К, Na. Зеленый оксид хрома (Ш) под названием «хромовая зеленая» применяется в качестве красителя. Сильнопрокаленный Сг203 инертен по отношению к кислотам и щелочам.
Высший оксид хрома СЮ3 обладает ярко выраженными окислительными свойствами. Он реагирует со взрывом со многими органическими веществами. Триокид хрома — это типичный кислотный оксид. Ему соответствуют сильные хромовая Н2Сг04 и дихромовая Н7Сг207 кислоты, известные только в растворе. В зависимости от кислотности среды анионы дихромата Сг207 и хромата СгО|" могут переходить друг в друга. Первый из них устойчив в кислой среде, а второй — в щелочной:
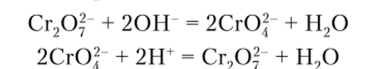
В обоих этих анионах атом хрома находится в тетраэдрическом окружении из атомов кислорода, один из которых в случае димерного иона выступает в роли мостика.
Галогениды. Хром образует многочисленные достаточно устойчивые галогениды, в которых он может находиться в степенях окисления от +5 до +2:
Фториды. | Хлориды. | Бромиды. | Йодиды. |
CrFg. | —. | —. | —. |
CrF,. | CrCl4 | CrBr4 | —. |
CrF3 | CrCl3 | CrBr3 | Crl3 |
CrF2 | CrCl2 | CrBr2 | Crl2 |
Тот факт, что ряд фторидов — самый представительный, а ряд йодидов — самый бедный, связан, в первую очередь, с относительными размерами: вокруг маленького иона хрома может быть координировано не более трех больших ионов иода.
Кроме этих галогенидов исключительно неустойчивый гексафторид хрома CrF6 получается в виде примеси при действии фтора под высоким давлением (350 ат, 400°С) на металл. Основная реакция.
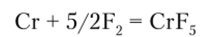
идет с понижением энтропии, поэтому и требуется такое высокое давление. Отметим, что оксофтроид хрома (У1) CrOF4 значительно устойчивее гексафторида. Гексафторид CrF6 представляет собой единственный гексагалогенид элемента первого переходного ряда.
Комплексные соединения. Традиционное понятие степени окисления металла сложилось применительно к координационным соединениям с донорными лигандами наиболее распространенного типа, прежде всего — молекулами воды. Ионы, отвечающие характерным степеням окисления, образуют устойчивые по отношению к окислению и восстановлению комплексы с большинством донорных лигандов, например [Cr (NH3)6]3+, [СгС16]3~, [Cr (NCS)6]3_ и многие другие.
Ионы Сг3+ не только отвечают характерной степени окисления хрома, но и имеют очень выгодную с точки зрения стабилизации нолем лигандов и с точки зрения образования инертных комплексов электронную конфигурацию d3. Все это делает ион Сг3+ универсальным комплексообразователем. Хорошо изучены многочисленные октаэдрические комплексы Сг (Ш) с нейтральными (Н20, NH3, NR3 идр.) и ацидолигандами (F, Cl, NCS, CN~, С904- и многими другими). Сами комплексы могут быть нейтральными, катионными или анионными.
Примером интересного нейтрального комплекса может служить ацетилацетонат хрома (Ш), который можно рассматривать как производное ацетилацетона СН3С (0)СН=СН (0Н)СН3; ацетилацетонатрый анион (Асас) представляет собой бидентатный лиганд, координирующиеся к центральному иону через два атома кислорода: 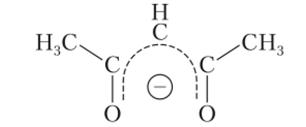
Нейтральный комплекс Сг (Асаспринадлежит к так называемым внутрикомплексным соединениям, в которых полидентатные хелатообразующие лиганды насыщают внутреннюю координационную сферу и нейтрализуют заряд центрального иона. Термодинамически устойчивый и кинетически инертный красно-фиолетовый комплекс Сг (Асас)., представляет собой довольно летучее твердое вещество с молекулярной кристаллической решеткой. Подобные летучие комплексы могут быть использованы для разделения и очистки переходных металлов.
Многие соединения Сг (Ш) находят практическое применение. Хорошо растворимые в воде хромокалиевые квасцы K2S04 • Cr2(S04);j • 24Н, 0 применяют при крашении тканей и дублении кож. В этих процессах роль Сг (Ш) связана с его способностью образовывать комплексы с молекулами белка.
Соединения Cr (IV) и Cr (V) в водных растворах неустойчивы.
Соединения Cr (VI), так же как оксид хрома Сг03, проявляют сильные окислительные свойства, например: 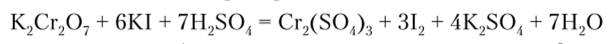
В кислой среде они обычно восстанавливаются до ионов Сг:и.