Моделирование газофазной окислительной конденсации метана.
Кинетический предел выхода этана и этилена

Таким образом, моделирование показало, что предел выхода С2-углеводородов при каталитической ОКМ имеет, по-видимому, газофазную природу и может быть определен на основании результатов газофазного моделирования. Более точный расчет величины этого предела должен учитывать неоднородность распределения метильных радикалов в объеме из-за их генерации на поверхности катализатора. Превышение… Читать ещё >
Моделирование газофазной окислительной конденсации метана. Кинетический предел выхода этана и этилена (реферат, курсовая, диплом, контрольная)
Процесс окислительной конденсации метана в этан и этилен (ОКМ), как уже отмечалось, является в общем случае гомогенногетерогенным процессом, и в большинстве экспериментально изученных систем роль катализа, по-видимому, заключается главным образом в генерации метильных радикалов, в то время как последующие газофазные реакции с их участием определяют состав и выход продуктов. Для проверки этой гипотезы было проведено кинетическое моделирование процесса окислительной конденсации метана, при этом гетерогенную генерацию метильных радикалов на различных катализаторах имитировали, варьируя начальную скорость их зарождения [407,408).
На основе хорошо зарекомендовавшей себя модели окисления метана при высоких давлениях [409−412] (см. табл. 5.2) в Институте химической физики разработана модель окислительной конденсации метана [407, 408]. Модель была опробована на имеющихся в литературе экспериментальных данных по окислительной конденсации метана в этан и этилен, полученных в заведомо гомогенных условиях [413— 416]. Было показано, что и при атмосферном и при повышенном давлениях в широком диапазоне температур модель удовлетворительно описывает процесс окислительного газофазного превращения метана в этан и этилен. В [408] ее успешно применили для описания более широкого круга процессов окисления метана, вплоть до распространения пламени в метан-воздушных смесях.
Для сопоставления процессов каталитической и газофазной окислительной конденсации метана необходимо было выяснить, способно ли дополнительное инициирование при газофазном процессе обеспечить при тех же условиях значительное увеличение выхода Ог-углеводородов. В качестве источника метильных радикалов при моделировании была выбрана реакция.

с эффективной константой скорости кэф, изменением которой моделировалось изменение скорости генерации метильных радикалов. Известно, что генерация радикалов по этой реакции может происходить как гомогенно, так и гетерогенно.
Результаты моделирования газофазной ОКМ с дополнительной генерацией радикалов по реакции (7.85) при типичных условиях каталитической ОКМ (Г = 1073 К, Р = 1 атм, CR*: 02: N2 = 10: 2: 12,5) представлены на рис. 7.30. Принципиальным результатом моделирования явилось обнаружение кинетического предела выхода (^-углеводородов при монотонном увеличении скорости генерации радикалов по реакции (7.85). Инициирование также существенно повышает конечную степень конверсии метана при заданной концентрации кислорода.
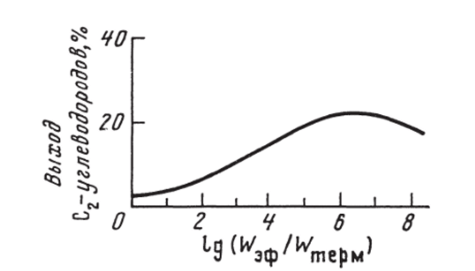
Рис. 7.30. Рассчитанный выход С2-углеводородов при изменении отношения скорости эффективной гомогенной генерации радикалов СН3 к скорости их гомогенной термической генерации VV3(j,/WTepM при Т = 1073 К, Р = 1 атм, СН4: 02: N2 = Ю: 2: 12,5 [408].
В то же время изменение температуры и давления процесса при оптимальном инициировании, соответствующем максимальному выходу С2-углеводородов, не сильно влияет на величину их максимального выхода.
В качестве других вариантов было рассмотрено инициирование с образованием в качестве первичных активных центров радикалов ОН или атомов Н. В этом случае образование С2-углеводородов возможно только после взаимодействия образовавшихся радикалов с исходными реагентами, что в большей степени отражает реальный процесс. При этом также наблюдается кинетический предел выхода (^-углеводородов, что подтверждает цепной характер процесса [408].
Сравнение результатов моделирования газофазной ОКМ с результатами каталитических экспериментов, приведенных, например, в [228], показывает, что в отсутствие дополнительного инициирования выход С2-углеводородов (-2,5%) соответствует результатам, полученным с наименее активными катализаторами (СаО). Однако увеличение скорости генерации радикалов достаточно для достижения выхода С2-углеводородов, близкого к полученному на лучших катализаторах (см. рис. 7.30). Но даже при очень высоких скоростях генерации радикалов выход С2-углеводородов для этого состава смеси не превышает предельного значения в 22%, очень близкого к 26%-му пределу, постулированному в [228] (см. раздел 7.3.1).
Полученная расчетная зависимость максимальной селективности образования С2-углеводородов при инициированной ОКМ от степени конверсии метана представлена на рис. 7.31 кривой /. Она отличается от предложенной в [228] гипотетической гиперболической зависимости (рис. 7.31, кривая 2). Рассчитанный выход (^-углеводородов растет с ростом конверсии метана, достигая -36% при больших величинах конверсии (рис. 7.32).
![Зависимость селективности образования С-углеводородов (5) от степени конверсии метана (а) при Т = 1073 К, Р = 1 атм (408].](/img/s/8/55/1565055_3.png)
Рис. 7.31. Зависимость селективности образования С2-углеводородов (5) от степени конверсии метана (а) при Т = 1073 К, Р = 1 атм (408].
/ - кинетический расчет для инициированной газофазной ОКМ; 2 — граница 25%-го выхода С2-углеводородов; 3 — кинетический расчет для неинициированной газофазной ОКМ; 4 — расчет зависимости селективности образования Сз-углеводородов от конверсии метана при изменении эффективной скорости генерации метильных радикалов для СН4: 02: N2 = 10:2: 12,5. Точки — экспериментальные результаты работ по каталитической ОКМ.
![Зависимость выхода С-углеводородов (У) от степени конверсии метана (а) при Т = 1073 К, Р = 1 атм f408].](/img/s/8/55/1565055_4.png)
Рис. 7.32. Зависимость выхода С2-углеводородов (У) от степени конверсии метана (а) при Т = 1073 К, Р = 1 атм f408].
I — кинетический расчет для инициированной газофазной ОКМ; // - кинетический расчет для неинициированной газофазной ОКМ. Точки — экспериментальные данные; /-Sm203; 2-СаО; 3-MgO.
При сопоставлении расчетов, проведенных для газофазного процесса, с результатами каталитических работ необходимо иметь в виду, что при моделировании было принято равномерное дополнительное генерирование метильных радикалов по объему реактора. Каталитическая генерация метальных радикалов на поверхности с учетом последующих процессов диффузии реагентов в условиях быстрой рекомбинации радикалов может приводить к несколько отличным значениям выходов. Кроме того, максимальный выход С2-углеводородов при каталитической ОКМ может достигаться при более низких скоростях эффективной генерации радикалов, чем скорости, полученные при данном способе моделирования, так как в узком приповерхностном слое, в который реальный катализатор поставляет метильные радикалы, вероятность их рекомбинации в этан существенно преобладает над остальными возможными реакциями.
Обнаруженный при моделировании газофазного процесса кинетический предел выхода С2-углеводородов фактически является пределом и для их каталитической ОКМ, если роль катализатора заключается только в генерации метильных радикалов и не затрагивает последующих процессов, влияющих на образование С2-углеводородов. Действительно, сопоставление полученной зависимости с результатами каталитических работ показывает, что подавляющее большинство результатов лежит ниже или вблизи кривой / (см. рис. 7.31).
На рис. 7.31 (кривая 3) и на рис. 7.32 (кривая II) приведены также рассчитанные зависимости селективности и выхода С2-углеводородов от степени конверсии метана для неинициированной реакции. Интересно отметить, что экспериментальные результаты, полученные с менее активными катализаторами (CaO, MgO), лежат вблизи расчетной кривой для неинициированной гомогенной реакции. В то же время для Sm203 — одного из наиболее эффективных катализаторов в этом процессе, полученный экспериментально выход хорошо ложится на рассчитанную зависимость выхода от степени конверсии метана для оптимально инициированного процесса (см. рис. 7.32). Все экспериментальные результаты взяты из работы [228].
Прямое экспериментальное сопоставление скоростей окислительной конденсации метана в присутствии и в отсутствие катализатора недавно было проведено в работе [417]. Авторы обратили особое внимание на конструирование изотермического реактора с интенсивным перемешиванием газа, благодаря чему во всем объеме реактора поддерживалась постоянная температура (от 650 до 900°С). Катализатор La203 помещался в виде одной, двух или трех таблеток, находящихся на одной и той же полке, перпендикулярной оси реактора. Это позволило в одинаковых условиях сопоставить гомогенную и гетерогенную реакции.
Полученные результаты показали, что селективности образования С2Н2, С2Н4, С2Н6, С3Н6 и С3Н8 при 900 °C почти одинаковы в газовой фазе и в присутствии катализатора. Селективность в образовании СО выше для газофазной реакции, а селективность в С02 выше для катализатора. Конверсия СН4 возрастает при переходе от газофазной реакции к каталитической (точнее, к реакции, инициированной катализатором). На двух таблетках скорость реакции вдвое больше, чем на одной, а на трех — втрое больше. Заметим, что эта работа является практически единственной работой, где в одинаковых условиях измерялась зависимость скорости окислительной конденсации от количества катализатора. При 750 °C С2-селективность для газовой фазы была 55%, а в присутствии катализатора всего 20%. Мы уже отмечали (см. раздел 7.4.3), что предельная С2-селективность должна быть выше в отсутствие катализатора (см. уравнение 7.32).
Полученные экспериментальные данные и рассмотрение элементарных реакций в газовой фазе и на поверхности (835 реакций! [418]) также привели авторов [417] к выводу, что при моделировании, кроме газофазных реакций, нужно учитывать только реакции инициирования: СН4 —> СН3, С2Н6 —> С2Н5, С2Н4 —" С2Н3, и гетерогенно-каталитическую реакцию окисления СО в С02.
Таким образом, моделирование показало, что предел выхода С2-углеводородов при каталитической ОКМ имеет, по-видимому, газофазную природу и может быть определен на основании результатов газофазного моделирования. Более точный расчет величины этого предела должен учитывать неоднородность распределения метильных радикалов в объеме из-за их генерации на поверхности катализатора. Превышение рассчитанного таким образом кинетического предела выхода С2-углеводородов может быть достигнуто только в том случае, если катализатор играет заметную роль и в последующих превращениях метильных радикалов, а не только в их гетерогенной генерации.