Буферные системы.
Аналитическая химия в 2 книгах.
Книга 1. Химические методы анализа

Универсальную буферную смесь готовят, смешивая растворы ортофосфорной, уксусной и борной кислот с раствором гидроксида натрия (поддерживает pH в широком интервале 1,81—11,98). Рассмотрим подробнее два типа буферных систем: систему, содержащую слабую кислоту и ее соль, и систему, содержащую слабое основание и его соль. Где рКк — показатель константы диссоциации слабой одноосновной кислоты; ск и… Читать ещё >
Буферные системы. Аналитическая химия в 2 книгах. Книга 1. Химические методы анализа (реферат, курсовая, диплом, контрольная)
Буферные системы (буферные растворы) — растворы, способные сохранять более или менее постоянное значение pH при добавлении к ним небольших количеств сильных кислот или сильных оснований. Такие растворы могут содержать одно вещество либо смесь веществ. К буферным растворам отдельных веществ относятся, например, насыщенный водный раствор гидротартрата калия КНС4Н406 (pH 3,567 при 25 °С), водный раствор (с концентрацией 0,05 моль/л) гидрофталата калия КНС8Н404 (pH 4,008 при 25 °С), водный раствор (с концентрацией 0,05 моль/л) тетрабората натрия (буры) Na2B4O7-10H2O (pH 9,18 при 25 °C и pH 9,07 при 38 °С).
Примерами буферных систем из смеси веществ могут служить водные растворы, содержащие:
— хлороводородную кислоту и глицин: НС1 + NH2CH2COOH (поддерживает pH в интервале 1,10—3,50);
- — гидроксид натрия и гидрофталат калия: NaOH + КНС8Н404 (поддерживает pH в интервале 4,00—6,20);
- — однозамещенный ортофосфат калия и двузамещенный ортофосфат натрия: КН2Р04 + Na2HP04 (поддерживает pH в интервале 4,80— 8,00);
- — уксусную кислоту и ацетат натрия: СН3СООН + CH3COONa (поддерживает pH в интервале 3,8—6,3).
Универсальную буферную смесь готовят, смешивая растворы ортофосфорной, уксусной и борной кислот с раствором гидроксида натрия (поддерживает pH в широком интервале 1,81—11,98).
Часто применяют буферные растворы, содержащие смесь слабой кислоты и ее соли (например, муравьиная кислота и формиат натрия НСООН + HCOONa — формиатный буферный раствор) или смесь слабого основания и соли этого основания (например, аммиак и хлорид аммония NH3-H20 + NH4C1 — аммонийный буферный раствор).
Для поддержания заданного постоянного значения pH буферный раствор готовят, смешивая точно рассчитанные количества компонентов.
Рассмотрим подробнее два типа буферных систем: систему, содержащую слабую кислоту и ее соль, и систему, содержащую слабое основание и его соль.
Буферная система, содержащая слабую кислоту и ее соль
Пример такой системы — ацетатная буферная смесь: водный раствор, содержащий слабую уксусную кислоту СН3СООН и ее соль — ацетат натрия CH3COONa. Ацетат натрия (сильный электролит) в водном растворе распадается на ионы полностью, уксусная кислота (слабый электролит) —лишь частично:
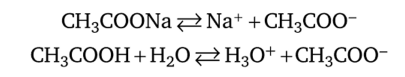
Последнее равновесие сильно смещено влево, так как диссоциация уксусной кислоты подавляется в присутствии ацетат-ионов.
Буферное действие ацетатной смеси заключается в следующем: если в буферную смесь прибавляют небольшой объем сильной кислоты, то ионы водорода этой кислоты, которые могли бы привести к изменению pH раствора, связываются ацетат-ионами в малодиссоциирующую уксусную кислоту:
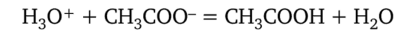
При этом баланс ионов водорода в растворе практически не нарушается, pH раствора сохраняется постоянным.
Если к этому раствору прибавить небольшой объем щелочи, то гидроксид-ионы щелочи связываются уксусной кислотой с образованием воды, pH раствора также практически не изменится:
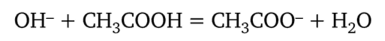
Рассчитаем pH в ацетатном буферном растворе. Концентрационная константа кислотной диссоциации уксусной кислоты:
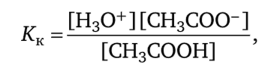
откуда.
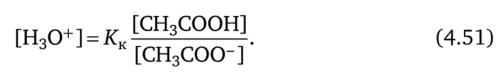
Степень диссоциации уксусной кислоты значительно меньше единицы (а = 0,0132), поэтому равновесная концентрация недиссоциированной кислоты [СН3СООН] приблизительно равна исходной концентрации кислоты ск, равновесная концентрация ацетат-ионов [СН3СОО] приближенно равна исходной концентрации ацетата натрия сс; [СН3СООН] = ск; |СН3СОО-] = сс.
Уравнение (4.51) примет вид.
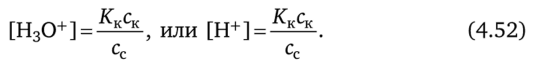
После логарифмирования уравнения (4.52) и умножения на -1 получаем.
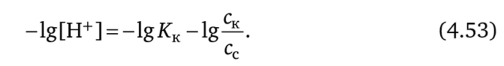
Вводим в уравнение (4.53) вместо отрицательных логарифмов показатели: pH = -lg[H+]; рКк = -lgКк, получаем уравнение для расчета pH буферной системы, состоящей из слабой кислоты и ее соли:

где рКк — показатель константы диссоциации слабой одноосновной кислоты; ск и сс — исходные концентрации слабой кислоты и соли, моль/л.
Уравнение (4.54) применяют для расчета pH буферных систем, содержащих слабую одноосновную или многоосновную кислоту и ее соль (в расчете используют константу первой ступени диссоциации).