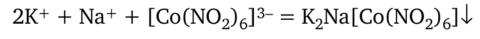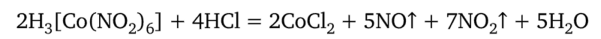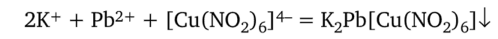Гексанитрокобальтат (Ш) натрия Na3[Co (N02)6]. Выделяет из растворов солей калия желтый кристаллический осадок двойной соли калия и натрия:
или.
Для выполнения реакции необходим свежеприготовленный раствор гексанитрокобальтата (Ш) натрия, так как при хранении реактив разлагается с выделением ионов Со2+, имеющих розовую окраску. Порозовевший раствор реактива непригоден к употреблению.
К 2—3 каплям раствора соли калия прибавляют 3 капли реактива и перемешивают. Выпадает желтый кристаллический (но не аморфный!) осадок.
Реакция достаточно чувствительна, предельное разбавление 1,3 • 104 мл/г. Можно выполнять ее на часовом или предметном стекле. При выполнении реакции необходимо соблюдать следующие условия. Анализируемый раствор должен иметь pH не больше 7, так как в щелочной среде реактив легко разлагается с выделением темнобурого аморфного осадка гидроксида Со (III):
В сильнокислой среде образуется очень нестойкая кислота H3[Co (N02)6]: 
которая в момент образования разлагается с выделением оксидов азота:
Однако в уксусной кислоте ни сам реактив, ни образующийся осадок не разрушаются.
Присутствие солей аммония мешает выполнению реакции, так как ион NH^ тоже образует желтый кристаллический осадок:
Ион Mg2+, образующий с реактивом растворимое соединение, обнаружению калия не мешает.
Таким образом, катион К+ следует обнаруживать действием гексанитрокобальтата (Ш) натрия Na3[Co (N02)6] в нейтральном или уксуснокислом растворе, который может содержать Mg2+, но не должен содержать солей аммония.
Тройной нитрит Na2Pb[Cu (N02)6]. Образует с солями К+ черные или коричневые кубические кристаллы K2Pb[Cu (N02)6]:
или.
На предметное стекло наносят каплю раствора соли калия и выпаривают досуха. Затем помещают рядом каплю реактива и смешивают палочкой с сухим остатком. Форму и цвет кристаллов рассматривают под микроскопом. Реакцию выполняют при pH 7.
Предельное разбавление — 7 • 103 мл/г, обнаруживаемый минимум — 0,15 мкг калия.
Ионы NH;J мешают обнаружению К+, так как тоже образуют с тройным нитритом черные кристаллы. Ионы Na+ и Mg2+ выполнению реакции не мешают.
Проба на окрашивание пламени. Летучие соли калия (например, КС1) окрашивают бесцветное пламя в характерный фиолетовый цвет.