Кривые кислотно-основного титрования

Для построения кривой кислотно-основного титрования рассчитывают значения pH титруемого раствора в различные моменты титрования: при pH исходного раствора; до точки эквивалентности; в точке эквивалентности и после точки эквивалентности. В кислотно-основном титровании расчет pH в разные моменты титрования зависит от силы кислоты или основания, используемых в титровании. Различают следующие виды… Читать ещё >
Кривые кислотно-основного титрования (реферат, курсовая, диплом, контрольная)
Кривые кислотно-основного титрования графически отображают зависимость изменения pH титруемого раствора от объема прибавленного титранта или степени оттитрованности /. По оси абсцисс откладывают объем прибавленного титранта или степень оттитрованности. По оси ординат прокладывают значения pH (pH = -lg[H+]) — получают логарифмическую кривую титрования. Анализ кривых титрования позволяет определить интервал АрН раствора вблизи ТЭ, т. е. величину скачка на кривой титрования, и выбрать подходящий индикатор так, чтобы значение показателя титрования рТ индикатора укладывалось внутри скачка pH на кривой титрования.
Для построения кривой кислотно-основного титрования рассчитывают значения pH титруемого раствора в различные моменты титрования: при pH исходного раствора; до точки эквивалентности; в точке эквивалентности и после точки эквивалентности.
В кислотно-основном титровании расчет pH в разные моменты титрования зависит от силы кислоты или основания, используемых в титровании. Различают следующие виды титрования:
- — сильной кислоты сильным основанием;
- — слабой кислоты сильным основанием;
- — слабого основания сильной кислотой;
- — многоосновных кислот сильным основанием;
- — солей, образованных катионами сильных оснований и анионами слабых кислот.
Титрование сильной кислоты сильным основанием.
При титровании сильной кислоты щелочью до ТЭ значение pH титруемого раствора определяется концентрацией исходной сильной кислоты. Для простоты расчетов допустим, что ионная сила раствора не изменяется, пренебрегаем изменением объема, принимаем значение степени диссоциации сильной кислоты равным единице. При этих допущениях для расчета pH до точки эквивалентности можно пользоваться формулой.
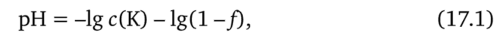
где с (К) — концентрация сильной кислоты, моль/л;/— степень оттитрованности,/= V (T)/V (K).
В ТЭ значение pH определяется концентрацией ионов водорода, поступающих за счет автопротолиза воды (если считать, что С02 не поглощается), Н+ +ОН~ Н20:

Среда в ТЭ — нейтральная.
За ТЭ значение pH определяется избытком добавленного титранта — сильного основания по формуле.
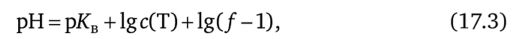
где рКв — постоянная воды (рКв = 14); с (Т) — концентрация титранта (щелочи), моль/л.
Пример
Титруемый раствор — 10,0 мл 0,1000 н. раствора НС1. Титрант — 0,1000 н. раствор NaOH, т. е. У (К) = 10 мл, с (К) = 0,1 моль/л, с (Т) = 0,1 моль/л.
До точки эквивалентности. Исходный раствор кислоты: НС1 Н+ + С1_; [Н+] = с (К) = 0,1 моль/л (f = 0);
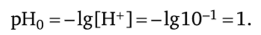
1. Добавим в титруемый раствор 5 мл 0,1 н. раствора NaOH: / = 5: 10 = 0,5;
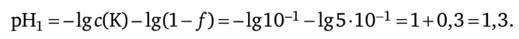
2. Добавим в титруемый раствор кислоты 9 мл 0,1 н. раствора NaOH: / = 9: 10 = 0,9 — концентрация ионов водорода уменьшилась в 10 раз;
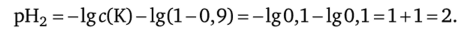
3. Добавим в титруемый раствор кислоты 9,9 мл 0,1 н. раствора NaOH: / = 9,9: 10 = 0,99 — концентрация ионов водорода уменьшается в 100 раз;
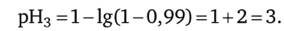
4. Добавим в титруемый раствор кислоты 9,99 мл 0,1 н. раствора NaOH: / = 9,99 :10 = 0,999 — концентрация ионов водорода уменьшается в 1000 раз;
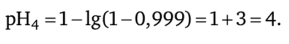
5. В точке эквивалентности рН5 7.
После точки эквивалентности. 6. Добавим 10,01 мл ОД н. раствора NaOH: / = 10,01 :10 = 1,001 — в титруемом растворе избыток щелочи.
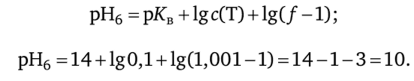
7. Добавим 10,1 мл 0,1 н. раствора NaOH:/ = 10,1:10 = 1,01 — в растворе избыток щелочи (0,1 мл);
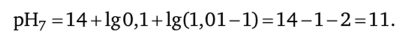
Проведенные расчеты представлены в табл. 17.3.
Результаты этих вычислений изображают графически: на оси абсцисс откладывают степень оттитрованности, а на оси ординат — соответствующие значения pH раствора. Получающийся график называют кривой титрования. На графике видно, что в конце титрования сильной кислоты сильным основанием происходит резкий скачок в изменении pH раствора.
Таблица 17.3
Изменение pH раствора при титровании сильной кислоты сильным основанием
Точка титрования. | V (T), добавлено NaOH, мл. | f V (T) 1 V (K). | Состав раствора. | Определяющие pH компоненты. | Значение. pH. |
НС1, Н20. | НС1. | 1,0. | |||
0,50. | НС1, Н20. | НС1. | 1,3. | ||
0,90. | НС1, Н20. | НС1. | 2,0. | ||
9,9. | 0,99. | НС1, Н20. | НС1. | 3,0. | |
9,99. | 0,999. | НС1, Н20. | НС1. | 4,0. | |
5(ТЭ). | 1,000. | Н20. | н20. | 7,0. | |
10,01. | 1,001. | NaOH, Н20. | NaOH. | 10,0. | |
10,1. | 1,01. | NaOH, Н20. | NaOH. | 11,0. |
За время нейтрализации 99,9% кислоты pH постепенно растет от 1 до 4, т. е. всего на три единицы. Зато при переходе от 0,1% избытка НС1 к 0,1% избытка NaOH pH раствора резко увеличивается (с 4 до 10). Это означает, что добавление одной капли щелочи в конце титрования понижает концентрацию ионов Н+ с 1СИ до 10″10 М, или в миллион раз (при повышении температуры и понижении концентрации растворов величина скачка pH на кривой несколько уменьшается).
В результате резкого изменения pH раствора от последней капли щелочи происходит и резкое изменение окраски индикатора. При отсутствии скачка pH на кривой окраска индикатора изменялась бы постепенно и определить конечную точку титрования было бы невозможно.
Кривая титрования ОД н. раствора хлороводородной кислоты ОД н. раствором гидроксида натрия показана на рис. 17.2.
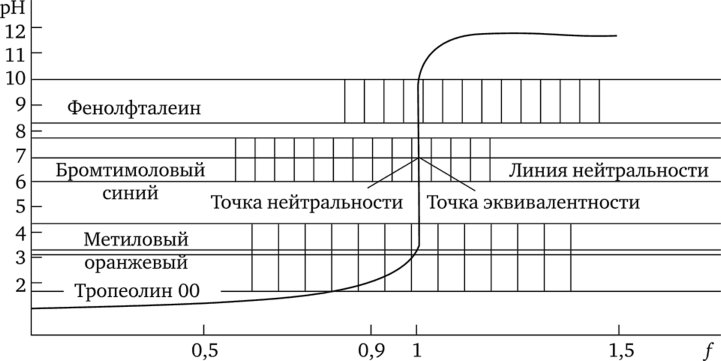
Рис. 17.2. Кривая титрования сильной кислоты сильным основанием и области перехода индикаторов.
При титровании сильной кислоты сильным основанием точка эквивалентности совпадает с точкой нейтральности (pH 7).
Зная особенности кривой титрования, выбирают подходящий индикатор. Для каждого случая титрования пригодны только те индикаторы, показатели титрования которых совпадают с пределами скачка pH на кривой. У фенолфталеина показатель титрования равен 9 (рТ = 9). Очевидно, что, применяя этот индикатор, титрование заканчивают в точке эквивалентности, а при некотором избытке щелочи, однако, он ничтожно мал. Ведь уже при избытке гидроксида натрия в ОД % pH раствора увеличивается до 10. Следовательно, с фенолфталеином раствор перетитровывают лишь на доли капли щелочи, чем вполне можно пренебречь.
У метилового оранжевого показатель титрования равен 4 (рТ = 4), а у метилового красного рТ = 5,5. Оба показателя совпадают с интервалом скачка pH на кривой.
Для растворов с концентрацией не ниже ОД н. можно сделать следующий вывод: при титровании сильной кислоты сильным основанием пригоден любой из важнейших индикаторов метода нейтрализации Сфенолфталеин, метиловый оранжевый и метиловый красный). Пригодны также бромтимоловый синий (рТ = 8) и тимолфталеин (рТ = 10).