Вывод выражения для внутренней энергии реального газа

Среднее значение энергии взаимодействия частиц. Внутренняя энергия идеального газа равна произведению Cv Т, если теплоемкость газа не зависит от его температуры. Энергия 1! вз взаимодействия есть отрицательная функция, удовлетворяющая условию (6.6). Т. е. график функции (6.21) имеет две асимптоты: V = b и Р = 0. Согласно свойству (6.22) давление в одном моле газа при его сжатии до объема 6… Читать ещё >
Вывод выражения для внутренней энергии реального газа (реферат, курсовая, диплом, контрольная)
Внутренняя энергия газа U есть среднее значение его полной энергии Е в системе отсчета, относительно которой газ в целом покоится:

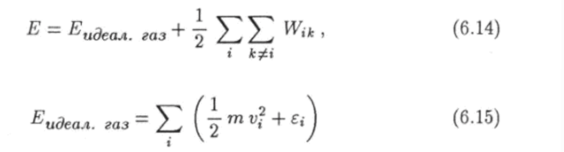
Энергию реального газа можно представить в виде суммы где.
— сумма энергий отдельных молекул без учета энергий их взаимодействия друг с другом, т. е. энергия идеального газа. Здесь v, и ?,• - скорость и внутренняя энергия молекулы под номером *. Двойная сумма в формуле (6.14) есть энергия взаимодействия всех молекул газа. В этой сумме Wik — энергия взаимодействия молекул с номерами i и к.
Среднее значение выражения (6.14), т. е. внутренняя энергия газа представляет собой функцию от температуры и объема, которую можно записать так:
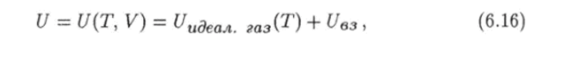
где.
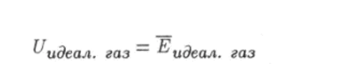
есть среднее значение энергии (6.15), т. е. внутренняя энергия идеального газа,.
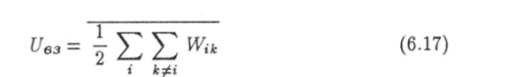
— среднее значение энергии взаимодействия частиц. Внутренняя энергия идеального газа равна произведению Cv Т, если теплоемкость газа не зависит от его температуры. Энергия 1!вз взаимодействия есть отрицательная функция, удовлетворяющая условию (6.6).
Средняя энергия 11вз взаимодействия молекул равна по величине работе, которую надо совершить против сил притяжения молекул для того, чтобы удалить их друг от друга на бесконечно большое расстояние. Давление АР, обусловленное притяжением молекул, определяется формулой (6.8), а работа против сил притяжения выражается интегралом.
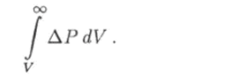
Поэтому средняя энергия взаимодействия молекул газа будет.
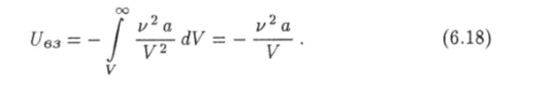
Итак, для внутренней энергии (6.13) реального газа будем иметь следующее выражение:
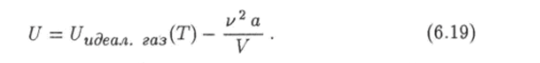
Это выражение можно получить более строго с математической точки зрения при помощи термодинамического равенства (1.49).
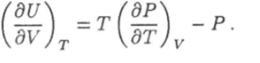
Подстановка в правую часть этого равенства функции (6.4) дает.
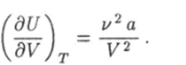
Интегрирование этого выражения по V с учетом условия (6.6) приводит к функции (6.19).
Изотермы газа Ван-дер-Ваальса
Исследуем изотермический процесс, протекающий в газе, состояния которого описываются уравнением Ван-дер-Ваальса (6.4). Положим для простоты в этом уравнении и — 1, т. е. будем рассматривать один моль газа. В этом случае уравнение (6.4) принимает вид При Т = const это равенство дает зависимость.


которая описывает изотермический процесс. Нетрудно видеть, что эта функция обладает свойствами.

т.е. график функции (6.21) имеет две асимптоты: V = b и Р = 0. Согласно свойству (6.22) давление в одном моле газа при его сжатии до объема 6 возрастает до бесконечности. Из этого следует, что объем моля газа не может быть меньше 6:
Для построения графика функции (6.21) ее следует исследовать на убывание, возрастание и экстремум, т. е. необходимо определить интервалы значений объема V, где она убывает или возрастает, и точки, в которых функция достигает экстремальных значений. С этой целью, используя выражение (6.20), найдем производную функции (6.21):


Необходимое условие экстремума функции.
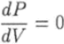
приводит к уравнению.

Это уравнение содержит в себе в качестве параметра температуру Т. Поэтому его решение будет видоизменяться в зависимости от того, какое значение принимает температура газа. Можно показать, что при достаточно высоких температурах, когда Т > Ткр, уравнение (6.25) не имеет корней в области V > 6. Значение Ткр называют критической температурой. В таком случае производная (6.25) всюду в области V > Ь отрицательна. Поэтому в соответствии с условиями (6.22) и (6.23) функция (6.21) в этой области будет монотонно убывающей, т. е. давление газа будет монотонно убывать от оо до 0 при увеличении объема от b до оо (рис. 6.10), если Т > ткр.
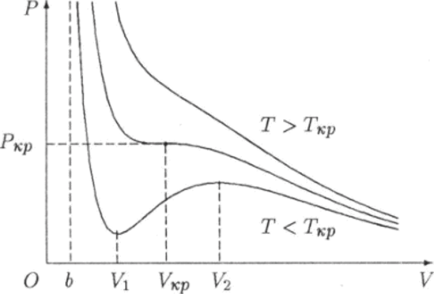
Рис. 6.10. Изотермы газа Ван-дер-Ваалъса.
При температуре Т < Ткр уравнение (6.26) имеет два корня V и Ц" которые удовлетворяют неравенству (6.24). При этих значениях объема производная (6.25) обращается в ноль, а функция (6.21) имеет минимум при V = V и максимум при V = Vq (рис. 6.10). В интервале (Vi, V2) производная функции Р = P (V) положительна:
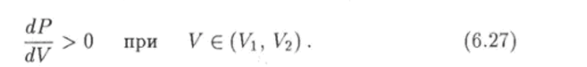
Это условие означает, что при расширении газа его давление увеличивается, а при сжатии оно уменьшается. Газ, обладающий таким свойством, не может существовать в однородном состоянии. Концентрация молекул газа вследствие их хаотического теплового движения флуктуирует, т. е. в небольших объемах она случайным образом изменяется с течением времени. Если в каком-то месте газа произошло его случайное сжатие, то при условии (6.27) давление газа здесь уменьшиться. Тогда давление окружающего газа будет сжимать газ в этом месте еще больше и его концентрация будет увеличиваться. Если же где-то концентрация газа случайным образом уменьшилась, т. е. произошло расширение газа, то возникшее повышенное давление будет способствовать дальнейшему расширению газа в этой области. Таким образом, в первоначально однородном газе возникнут области с повышенной и пониженной концентрацией молекул, т. е. молекулы газа будут распределены неравномерно в пространстве. Другими словами, произойдет расслоение (распад) пространственно однородного вещества на две фазы: газообразную и конденсированную. По этой причине неравенство (6.27) называется условием абсолютной неустойчивости однородного состояния реального газа.
Когда температура газа принимает критическое значение Ткр, уравнение (6.26) имеет только один корень, который обозначают как VKp. При этом значении объема производная (6.25) обращается в ноль, а соответствующая точка на графике является точкой перегиба (рис. 6.10), т. е. в этой точке вторая производная функции Р = P (V) также равна нулю:
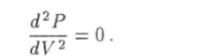
Это условие приводит к уравнению.
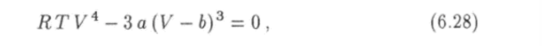
которое вместе с уравнением (6.26) образует систему для критических значений температуры и объема. Решив эту систему, найдем, что.
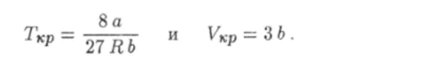
Этим значениям температуры и объема соответствует по формуле (6.20) критическое значение давления
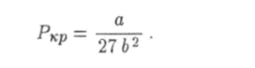
Состояние вещества при критических значениях температуры Ткр и давления ЛсР также называется критическим.