Синтез и хромато-масс-спектрометрия 1, 6-диалкил-3, 4-дигидрокси-2, 4-гексадиен-1, 6-дионов

Нами исследованы процессы масс-распада тетракарбонильных соединений с алифатическими заместителями под действием электронного удара с использованием хромато-масс-спектрометрии (схема 2). Для 1,6-диалкил-3,4-дигидрокси-2,4-гексадиен-1,6-дионов (1a-g) преобладающими являются два основных направления фрагментации. Первое направление Ф1 связано с разрывом связи С (3)О — С (4)О с образованием двух… Читать ещё >
Синтез и хромато-масс-спектрометрия 1, 6-диалкил-3, 4-дигидрокси-2, 4-гексадиен-1, 6-дионов (реферат, курсовая, диплом, контрольная)
СИНТЕЗ И ХРОМАТО-МАСС-СПЕКТРОМЕТРИЯ 1,6-ДИАЛКИЛ-3,4-ДИГИДРОКСИ-2,4-ГЕКСАДИЕН-1,6-ДИОНОВ
Карманова О.Г.
аспирант Практически значимые 1,6-дизамещенные 1,3,4,6-тетраоксогексаны (3,4-дигидрокси-2,4-гексадиен-1,6-дионы) характеризуются значительным своебразием строения (прототропные формы, кольчато-цепная таутомерия и кольчато-кольчатые интерконверсии), препаративной доступностью и выраженной реакционной способностью по отношению к нуклеофилам [5—7, 9].
В результате сложноэфирной конденсации Клайзена алкилметилкетонов с диэтилоксалатом в присутствии метилата натрия при соотношении реагентов 2:1:2 с последующим подкислением соляной кислотой нами получены целевые 1,6-диалкил-3,4-дигидрокси-2,4-гексадиен-1,6-дионы (1a-g: формы 1А, 1В, 1С) (схема 1) [2—4]. Характеристики и данные ИК и ЯМР 1Н спектроскопии полученных соединений (1a-d) представлены в статье [2].
По данным хромато-масс-спектрометрии в реакционной смеси нами впервые кроме тетракетонов (1) обнаружены побочные продукты: представитель ацилпируватов — метиловый эфир 2-гидрокси-4-оксо-2-пентеновой кислоты (2), а также производное 1,2-циклопентандиона — 3-бутаноил-4-метилциклопент-3-ен-1,2-дион (3). К сожалению, в свободном виде соединения (2) и (3) не получены. Однако при проведении оксалильной конденсации пропанона с 2-пентаноном нам удалось выделить смесь (3Z, 5Z)-4,5-дигидроксиокта-3,5-диен-2,7-диона (1a), содержание 60% и (5Z, 7Z)-6,7-дигидроксидодека-5,7-диен-4,9-диона (1с), содержание 40%. Относительное содержание компонентов по данным хромато-масс-спектрометрии иное, чем непосредственно в смесях, и это обусловлено особенностями метода (см. Экспериментальную часть).
Деструктивные методы исследования тетракетонов (1) для изучения их строения методом масс-спектрометрии, применялись ранее для установления структуры и исследования фрагментации 1,6-диарил-3,4-дигидрокси-2,4-гексадиен-1,6-дионов [8]. Характер и особенности масс-фрагментации 1,6-диалкил-3,4-дигидрокси-2,4-гексадиен-1,6-дионов (1) до наших исследований не изучались.
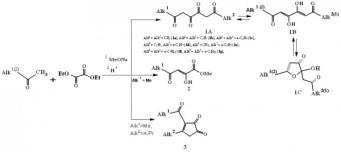
Схема 1.
Нами исследованы процессы масс-распада тетракарбонильных соединений с алифатическими заместителями под действием электронного удара с использованием хромато-масс-спектрометрии (схема 2). Для 1,6-диалкил-3,4-дигидрокси-2,4-гексадиен-1,6-дионов (1a-g) преобладающими являются два основных направления фрагментации. Первое направление Ф1 связано с разрывом связи С (3)О — С (4)О с образованием двух равноценных алканоилацетильных звена. Вторым значимым направлением фрагментации является отщепление алканоильного иона с одновременным образованием иона Ф3 (М-Alk1(2)CO+). При этом наиболее интенсивными пиками являются RCOCH2CO+ и RCO+, образующиеся при б-р азрыве связей в молекуле. Так, при таком разрыве появляются пики с массовыми числами m/z: 85 MeCOCH2CO+ (1a, 1g), 99 EtCOCH2CO+ (1b, 1d, 1f, 1g), 113 PrCOCH2CO+ (1c, 1d, 1e, 1f, 1g), а также 43 MeCO+ (1a-g), 57 EtCO+ (1b, 1d, 1f, 1g), 71 PrCO+ (1c, 1d, 1e, 1g) (таблица 1).
Сигналы ионов, образующихся при дегидратации молекулярного катион-радикала [М—18]+, со значениями массовых чисел m/z 170 (1b, 1e), 208 (1c), 194 (1d), 264 (1f) свидетельствует о направлении фрагментации с элиминированием молекулы воды из равновесной фрагментируемой структуры (1С). Фрагментный ион Ф7 с малой интенсивностью 0,04—0,56% образуется в результате декарбонилирования исходного молекулярного иона по механизму скелетной перегруппировки с выбросом молекулы оксида углерода (II). В масс-спектре отмечен пик [М-42], образование которого обусловлено фрагментацией первичного осколка Ф1, сопровождающийся элиминированием кетенового иона (-CH2=C=O+), m/z 42.
Схема 2.
Для каждого образующегося в результате фрагментации иона приведены значения формальной ненасыщенности (ФН) [1] и соответствующие им функциональные звенья (таблица). Рассчитанное нами значение ФН позволяет установить строение 1,6-диалкил-3,4-дигидрокси-2,4-гексадиен-1,6-дионов (1a-g). При значении ФН равном 4 возможно существование соединений (1a-g) в виде следующих возможных структур: 1) наличие в молекуле четырех карбонильных групп (форма 1А); 2) наличие в структуре двух карбонильных групп и двух двойных связей С=С (форма 1В); 3) присутствие одного ароматического кольца, двух карбонильных групп и одной двойной связи С=С (форма 1С). Нами выведены общие молекулярные формулы для молекулярного и фрагментных ионов, подходящих для любых алифатических 1,3,4,6-тетракетонов.
тетракетон алифатический заместитель спектрометрия Таблица 1 Основные ионы, образующиеся при масс-фрагментации соединений (1), (2), (3) и их характеристики.
Соединение. | R1. | R2. | m/z. | Iотн.,%. | М+ (Фn+). | Брутто-формула. | ФН*. | ГИ**. |
1а. | CH3. | CH3. | 2,2. | M+. | C8H10O4. | |||
1,3. | M — CO+. | C7H10O3. | ||||||
15,5. | M — MeCO+. | C5H5O3. | ||||||
2,2. | MeCOCH2COCO+. | C5H5O3. | ||||||
MeCOCH2CO+. | C4H5O2. | |||||||
6,6. | O=C— CH=C=O+. | C3HO2. | ||||||
2,1. | CH2CH=CO+. | C3H3O. | ||||||
64,4. | MeCO+. | C2H3O. | ||||||
1b. | C2H5. | C2H5. | 0,19. | M+. | C10H14O4. | |||
0,20. | M — CO — H+. | С9H13O3. | ||||||
1,05. | M — H2O+. | C10H12O3. | ||||||
0,08. | M — CH2CO+. | C8H12O3. | ||||||
11,13. | EtCOCH2COCO+. | C7H9O3. | ||||||
EtCOCH2CO+. | C5H7O2. | |||||||
0,34. | Ѕ M — H+. | C5H6O2. | ||||||
2,33. | EtCOCH2+. | C4H5O2. | ||||||
27,21. | EtCO+. | C3H5O. | ||||||
13,0. | MeCO+. | C2H3O. | ||||||
1c. | C3H7. | C3H7. | 0,04. | M+. | C12H18O4. | |||
0,04. | M — H2O+. | C12H16O3. | ||||||
0,56. | M — CO+. | C11H18O3. | ||||||
0,08. | M — CH2CO+. | C10H16O3. | ||||||
7,83. | M — PrCO+. | C8H11O3. | ||||||
PrCOCH2CO+. | C6H9O2. | |||||||
1,54. | Ѕ M — H+. | C6H8O2. | ||||||
0,50. | PrCOCH2+. | C5H9O. | ||||||
16,30. | PrCO+. | C4H7O. | ||||||
21,71. | MeCO+. | C2H3O. | ||||||
1d. | C2H5. | C3H7. | 0,17. | M+. | C11H16O4. | |||
0,06. | M — H2O+. | C11H14O3. | ||||||
1,33. | M — CO+. | C10H16O3. | ||||||
0,18. | M — СО —Н+. | C10H15O3. | ||||||
0,05. | M — CH2CO+. | C9H14O3. | ||||||
0,21. | M—CH2CO—Н+. | C9H13O3. | ||||||
8,59. | EtCOCH2COCO+. | C8H11O3. | ||||||
7,83. | PrCOCH2COCO+. | C7H9O3. | ||||||
PrCOCH2CO+. | C6H9O2. | |||||||
1,91. | Ѕ M — H+. | C5H7O4. | ||||||
82,20. | EtCOCH2CO+. | C5H7O2. | ||||||
17,40. | PrCO+. | C4H7O. | ||||||
24,60. | EtCO+. | C3H5O. | ||||||
30,35. | MeCO+. | C2H3O. | ||||||
1e. | CH3. | C3H7. | 0,31. | M+. | C10H14O4. | |||
1,41. | M — H2O+. | C10H12O3. | ||||||
8,69. | MeCOCH2COCO+. | C8H11O3. | ||||||
6,28. | PrCOCH2COCO+. | C6H7O3. | ||||||
PrCOCH2CO+. | C6H9O2. | |||||||
1,14. | Ѕ M — H+. | C5H6O2. | ||||||
58,45. | MeCOCH2CO+. | C4H5O2. | ||||||
13,91. | PrCO+. | C4H7O. | ||||||
54,23. | MeCO+. | C2H3O. | ||||||
1f. | C5H11. | C5H11. | 2,32. | M+. | C16H26O4. | |||
1,32. | M — H2O+. | C16H24O3. | ||||||
0,48. | M — CO — H2O+. | C15H24O2. | ||||||
1,13. | PrCOCH2COCO+. | C12H19O3. | ||||||
6,71. | M — EtCOCH2CO+. | C11H19O2. | ||||||
C5H11COCH2CO+. | C8H14O2. | |||||||
1,84. | PrCOCH2CO+. | C6H9O2. | ||||||
7,35. | EtCOCH2CO+. | C5H7O2. | ||||||
9,45. | EtCO+. | C3H5O. | ||||||
11,87. | MeCO+. | C2H3O. | ||||||
1g. | C6H13. | C6H13. | 1,92. | M+. | C18H30O4. | |||
0,83. | M — CO+. | C17H30O3. | ||||||
0,64. | M — CO — 2H+. | C17H28O3. | ||||||
0,32. | M — EtCOCH2CO+. | C13H23O2. | ||||||
11,23. | M — PrCOCH2CO+. | C12H21O2. | ||||||
C6H13COCH2CO+. | C9H15O2. | |||||||
8,56. | PrCOCH2CO+. | C6H9O2. | ||||||
2,23. | EtCOCH2CO+. | C5H7O2. | ||||||
3,42. | MeCOCH2CO+. | C4H5O2. | ||||||
6,28. | PrCO+. | C4H7O. | ||||||
17,83. | MeCO+. | C2H3O. |
Работа выполнена в рамках диссертационного исследования аспиранта кафедры химии Пермского государственного педагогического университета Кармановой О. Г.
Экспериментальная часть.
Общая методика синтеза 1,6-диалкил-3,4-дигидрокси-2,4-гексадиен-1,6-дионов (1a-g). К 100 мл метанола, предварительно перегнанного над натрием, добавляют порциями 1,15 г (50 ммоль) натрия, метанол отгоняют, к сухому метилату натрия добавляют 150 мл абсолютного диэтилового эфира, при охлаждении и перемешивании прибавляют по каплям смесь 3,7 мл (50 ммоль) пропанона (для синтеза соединения 1а), 4,4 мл (50 ммоль) бутанона (для синтеза соединения 1b), 5,3 мл (50 ммоль) 2-пентанона (для синтеза соединения 1c), 2,2 мл (25 ммоль) бутанона и 2,7 мл (25 ммоль) 2-пентанона (для синтеза соединения 1d), 1,9 мл пропанона (25 ммоль) и 2,9 мл 2-пентанона (25 ммоль) (для синтеза соединения 1е), 5,2 мл 2-гептанона (для синтеза соединения 1f), 7,8 мл 2-октанона (50 ммоль) (для синтеза соединения 1g) и 3,4 мл (25 ммоль) диэтилоксалата и нагревают 1—2 часа. Осадок отфильтровывают, добавляют при перешивании и охлаждении 15 мл 15% соляной кислоты, продукт кристаллизуют из этилацетата. Получают бесцветные кристаллы соединений (1a—g).
Хромато-масс-спектры записаны на приборе Agilent Technologies 6890 N/5975 В, колонка HP-5ms, 30 м х 0,25 мкм, газ-носитель — гелий (1 мл/мин), ионизация электронным ударом (70 эВ).
(3Z, 5Z)-4,5-дигидроксиокта-3,5-диен-2,7-дион (1a), (5Z, 7Z)-6,7-дигидроксидодека-5,7-диен-4,9-дион (1с) и 3-ацетил-4-пропил-3-циклопентен-1,2-дион (3).
Константы, выходы и спектральные характеристики индивидуальных соединений (1а) и (1с) описаны в статье [2]. По данным ЯМР 1Н смесь компонентов (1а) и (1с) выделена в соотношении 60% и 40%, соответственно. Хромато-масс-спектр, время удерживания, мин.: компонент (1а) 5,6 мин., компонент (1е) 6,5 мин., компонент (1с) 7,3 мин., компонент (3) 6,3 мин. Mасс-спектрометрические данные соединений (1а) и (1с) приведены в таблице.
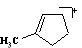
Соединение (3), масс-спектр, m/z (I, %): 180 (10,16) М+, 165 (4,52) М — Ме+, 152 (15,43) M — Me+, 137 (37,16) M — Pr+, 123 (5,21) M — CO — H+, 109 (16,89) M — PrCO+, 95 (13,20) MeCOCH=C=O+, 82 (100), 67 (14,12) C6H10 — Me+, 55 (12,23), С3Н3О+, 43 (9,2) Pr+, 41 (23,1) CH=C=O+.
(4Z, 6Z)-5,6-дигидроксидека-4,6-диен-3,8-дион (1b), (5Z, 7Z)-6,7-дигидроксидодека-5,7-диен-4,9-дион (1с), (4Z, 6Z)-5,6-дигидроксиундека-4,6-диен-3,8-дион (1d).
Константы, выходы и спектральные характеристики индивидуальных соединений (1b, 1c, 1d) представлены в статье [2].
Хромато-масс-спектр, время удерживания, мин.: компонент (1b) 6,5 мин., компонент (1d) 6,9 мин., компонент (1с) 7,3 мин. Mасс-спектрометрические результаты исследования идентифицированных соединений приведены в таблице.
- 1. Иоффе Б. В., Костиков Р. Р., Разин В. Ф. Физические методы определения строения органических соединений. М., Высшая школа, 1984, 336 с.
- 2. Карманова О. Г., Козьминых В. О., Муковоз П. П., Козьминых Е. Н. Синтез и структурное разнообразие 1,6-диалкил-3,4-дигидрокси-2,4-гексадиен-1,6-дионов // Известия высших учебных заведений. Химия и химическая технология. Иваново: ИГХТУ, 2012 (в печати, рег. номер 4413).
- 3. Карманова О. Г., Зыкова С. С., Муковоз П. П., Козьминых В. О. Новый модифицированный метод получения 1,6-диалкилзамещенных 3,4-дигидрокси-1,6-гексадиен-1,6-дионов // Современные фундаментальные и прикладные исследования. Кисловодск, 2011. С. 106—109.
- 4. Карманова О. Г., Зыкова С. С., Козьминых В. О., Муковоз П. П. Синтез и особенности строения 1,6-диалкилзамещенных 1,3,4,6-тетраоксогексанов // Научное творчество XXI века. Том 3. Красноярск, 2012. С. 264—269.
- 5. Кириллова Е. А., Козьминых В. О. Синтез, цепная таутомерия и кольчато-цепные интерконверсии замещённых 3,4-дигидрокси-2,4-алкадиен-1,6-дионов // Вестник Южно-Уральского гос. ун-та. Серия «Химия». Вып. 2. Челябинск, 2009. № 23 (156). С. 9—15.
- 6. Кириллова Е. А., Муковоз П. П., Виноградов А. Н., Козьминых В. О., Дворская О. Н. Синтез, особенности строения и таутомерия 1,6-дизамещённых 3,4-дигидрокси-2,4-гексадиен-1,6-дионов // Известия высших учебных заведений. Химия и химическая технология. Иваново: ИГХТУ, 2011. Т. 54. № 4. С. 18—22.
- 7. Козьминых В. О., Гончаров В. И., Козьминых Е. Н. Конденсация Клайзена метилкетонов с диалкилоксалатами в синтезе биологически активных карбонильных соединений (обзор, часть 3) // Вестник Оренбургского гос. ун-та. Оренбург, 2007. Вып. 5 (69). С. 138—148.
- 8. Laжan М., Vukiжeviж М., Dћaniж Н., Stefanoviж D. The mass spectra of some aromatic polyketones // Org. Mass Spectrom. — 1975. — N 10. — P. 899—904.
- 9. Poje M., Balenoviж К. 3(2H)-Furanone derivatives. Ring-chain tautomerism in the 1,3,4,6-tetraketone // J. Heterocycl. Chem. — 1979. — Vol. 16. — N 3. — P. 417—420.