Физико-химические основы синтеза
Соотношение аммиака и кислорода в газовой смеси влияет на температурный режим и общую скорость процесса в том случае, если лимитирующей в нем является химическая реакция, то есть процесс протекает в кинетической области. При стехиометрическом соотношении компонентов в АВС степень превращения аммиака в оксид азота (II) не превышает 0,65 дол. ед. Для увеличения выхода оксида азота (II) процесс… Читать ещё >
Физико-химические основы синтеза (реферат, курсовая, диплом, контрольная)
Получение азотной кислоты методом прямого синтеза основано на взаимодействии жидких оксидов азота с водой и кислородом под давлением и при повышенной температуре. Технологическая схема производства кислоты включает в себя следующие стадии:
- 1. Получение аммиачно-воздушной смеси.
- 2. Окисление аммиака
- 3. Охлаждение нитрозных газов и окисление NO до NO2
- 4. Абсорбция оксидов азота
При окислении аммиака кислородом воздуха на катализаторе возможно протекание следующих реакций:
NH3 + 5О2 = 4NO + 6Н2О — ДН ДН=907,3 кДж (1).
NH3 + 4О2 = 2N2О + 6Н2О — ДН ДН = 1104,9 кДж (2).
NH3 + 3О2 = 2N2 + 6Н2О — ДН ДН = 1269,1 кДж (3).
а также реакция с участием образующегося оксида азота (II):
4NH3 + 6NO = 5N2 + 6H2О-ДН ДН = 110 кДж (4).
Все реакции практически необратимы, поэтому направление процесса окисления определяется соотношением скоростей реакций 1−4. Из трех основных реакций окисления аммиака (1−3) реакция 3 термодинамически наиболее вероятна, так как протекает с максимальным выделением тепла. Поэтому, в отсутствии катализатора окисление аммиака идет преимущественно до элементарного азота.
Для ускорения целевой реакции окисления до оксида азота (II) применяют селективно действующие катализаторы. В современных установках используют платиновые катализаторы в виде пакета сеток из сплава платины с 7,5% родия, или двухступенчатые катализаторы в виде слоя таблетированной смеси оксидов железа (III) и хрома (III).
Введение
родия повышает механическую прочность и уменьшает потери платины за счет ее уноса током газа. Механизм гетерогенного каталитического окисления аммиака состоит из следующих последовательных стадий:
- — диффузия молекул аммиака и кислорода из газовой фазы к поверхности катализатора;
- — активированная адсорбция молекул кислорода на поверхности катализатора с образованием промежуточного соединения;
- — хемосорбция молекул аммиака и образование комплекса;
- — разложение комплекса с регенерацией катализатора и образованием молекул оксида азота (II) и воды;
- — диффузия продуктов реакции с поверхности катализатора в газовую фазу.
Определяющей стадией всего процесса окисления является скорость диффузии кислорода к поверхности катализатора. Следовательно, каталитическое окисление аммиака на платиновом катализаторе протекает преимущественно в диффузионной области, в отличие от окисления на окисном катализаторе, которое идет в кинетической области.
Платиновые катализаторы чувствительны к каталитическим ядам, содержащимся в аммиаке и воздухе, образующим аммиачно-воздушную смесь (АВС). Так как вследствие этого активность катализатора снижается, его периодически регенерируют промывкой соляной или азотной кислотой.
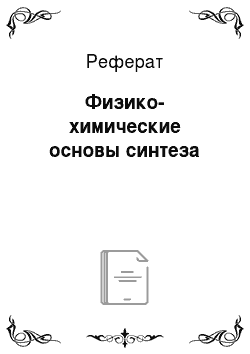
В процессе работы поверхность катализатора разрушается, и частицы его уносятся с потоком газа. Эрозия катализатора тем больше, чем выше температура, давление и объемная скорость газа, проходящего через катализатор. В присутствии платиновых катализаторов селективность процесса окисления аммиака до оксида азота (II):
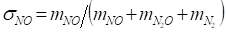
составляет 0,95−0,98 дол, ед. В этих условиях скорость окисления до оксида азота (II) описывается уравнением:

где — парциальное давление аммиака, окисляемого до оксида азота (II);
- парциальное давление аммиака, окисляемого до оксида азота (I) и элементарного азота;
к — константа скорости.
Энергия активации этой реакции составляет 33,494 кДж/ моль.
и зависит от таких параметров процесса как температура (через Км), давление и состав АВС, то есть отношение кислород: аммиак, время контактирования, то есть время пребывания АВС в зоне катализатора. Влияние этих факторов на скорость окисления аммиака до оксида азота (II) по реакции и до азота по реакции и, следовательно, выход продуктов окисления, различно.
Повышение температуры способствует увеличению скорости реакций и коэффициента диффузии аммиака в смеси и, поэтому, является наиболее эффективным средством, увеличения скорости процесса, протекающего преимущественно в диффузионной области. Это подтверждается термодинамическими данными таблицы.
Термодинамические характеристики реакций окисления аммиака.
Реакция. | ДН, Дж/моль. | ДG, кДж/моль. | |
298°К. | 1173оК. | ||
4NH3 + 5О2 = 4NO + 6Н2О. | — 226,0. | — 246,2. | — 414,6. |
4NH3 + 3О2 = 2Н2 + 6Н2О. | — 317,2. | — 326,9. | — 335,2. |
Из таблицы следует, что вероятность реакции окисления до оксида азота (II) с повышением температуры возрастает почти вдвое, а реакции окисления до азота почти не изменяется.
Соотношение аммиака и кислорода в газовой смеси влияет на температурный режим и общую скорость процесса в том случае, если лимитирующей в нем является химическая реакция, то есть процесс протекает в кинетической области. При стехиометрическом соотношении компонентов в АВС степень превращения аммиака в оксид азота (II) не превышает 0,65 дол. ед. Для увеличения выхода оксида азота (II) процесс ведут при отношении О2: NH3 = 1,8−2,0, что соответствует содержанию в АВС 0,095−0,105 объёмных долей аммиака и 0,18−0,19 объёмных долей кислорода. Избыток кислорода используется на стадии доокисления оксида азота (II), а указанный состав АВС обеспечивает автотермичность процесса окисления и лежит за пределом взрывчатости АВС.
Повышение давления ускоряет процесс окисления аммиака за счет увеличения концентрации реагентов и производительности катализатора, что позволяет сократить размеры аппаратуры. При этом, однако, снижается выход оксида азота (II) и увеличивается эрозия и унос катализатора, что удорожает продукцию.
Скорость каталитического окисления аммиака до оксида азота (II) весьма высока. За десятитысячные доли секунды степень превращения составляет 0,97 — 0,98 дол. ед. при атмосферном давлении и 0,96−0,98 при давлении 0,8−1,0 МПа. Время контактирования может быть рассчитано из формулы:
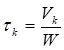
где Vk - объем катализатора, определяемый в случае платинового катализатора числом сеток в пакете; W — объемная скорость АВС.
Время контактирования зависит от природы катализатора и составляет; для платиновых катализаторов 10-4 — 10-5 с, для окисных катализаторов около 10-2 с. Увеличение времени контактирования, то есть снижение объемной скорости АВС приводит к развитию реакции окисления аммиака до элементарного азота.
Оптимальный режим процесса на этой стадии должен обеспечить селективность окисления аммиака, минимальные потери катализатора вследствие его уноса и автотермичность процесса. Этим требованиям удовлетворяют следующие условия: температура 800 °C, давление 0,1−1,0 МПа, молярное отношение О2: NH3 — 1,8−2,0, время контактирования 1−2· 10-4 с.
Для соблюдения этих условий исходная АВС должна иметь состав: аммиак 0,10−0,115 об. дол., кислород 0,18−0,19 об. дол., азот 0,70−0,72 об. дол.
При использовании АВС такого состава нитрозные газы, выходящие из контактного аппарата, содержат от 0,08 до 0,11 об. дол, оксида азота (II).
Нитрозные газы, поступающие на абсорбцию, представляют сложную смесь различных оксидов азота (NO2, N2O4, NO, N2О), элементарного азота, кислорода и паров воды. Их состав зависит от условий окисления, то есть от состояния системы, описываемого реакциями 9−11.
Все оксиды азота, входящие в состав нитрозных газов, нерастворимы в воде, но, за исключением оксида азота (II), взаимодействуют с ней. Поглощение их водой сопровождается химической реакцией хемосорбции, протекающей в системе «газ — жидкость», описываемой уравнениями:
где ДН=116 кДж.
где ДН=59 кДж и распада нестойкой азотистой кислоты по уравнению:
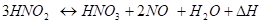
.
где ДН=76 кДж Суммируя уравнения, получаем итоговые уравнения поглощения оксидов азота водой:
где ДН=136 кДж.
где ДН=101 кДж Из этих уравнений следует, что при абсорбции из трех моль оксида азота (IV) образуется два моля азотной кислоты и один моль оксида азота (II), который возвращается в цикл и снова окисляется до оксида азота (IV).
Механизм образования азотной кислоты при абсорбции оксида азота (IV) водой, а затем образующейся водной азотной кислотой, заключается в том, что оксид азота (IV) диффундирует через пограничный слой газа к поверхности жидкости и абсорбируется ею. При этом оксид азота (IV) реагирует с водой со скоростью, превышающей скорость диффузии и скорость реакции разложения азотистой кислоты.
Образующийся оксид азота (II) выделяется в газовую фазу, где окисляется кислородом до оксида азота (IV). Скорость процесса абсорбции оксида азота (IV) водой описывается уравнением для гетерогенных процессов:

где Др — движущая сила абсорбции;
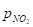
— парциальное давление NO2 в газовой фазе;

— равновесное давление NO2 у поверхности водного раствора азотной кислоты.
С повышением концентрации кислоты в процессе абсорбции возрастает равновесное давление оксида азота (IV) и снижается движущая сила процесса. Вследствие этого процесс абсорбции замедляется (рисунок 1).

Рисунок 1 — Зависимость абсорбционного объема от степени абсорбции.
Состояние системы «NO2-HNO3-H2O» и, следовательно, концентрация получаемой азотной кислоты зависит от температуры, давления, парциального давления оксида азота (IV) в поглощаемой газовой смеси и концентрации образовавшейся кислоты. При понижении температуры и концентрации кислоты и повышении давления степень абсорбции оксида азота (IV) водной азотной кислотой возрастает, тем интенсивнее, чем выше концентрация его в нитрозных газах. При атмосферном давлении и температуре 25 °C абсорбция оксида азота практически прекращается, когда концентрация кислоты достигнет 0,65 масс. долей (рис.2).
Таким образом, возможность получения азотной кислоты концентрацией более 0,65 масс. дол. объективно ограничена температурой и давлением процесса абсорбции и содержанием оксида азота (IV) в нитрозных газах. В реальных условиях производства при температуре 40 оС, давлении 0,1 МПа и понижении содержания оксида азота вследствие его поглощения из газа концентрация получаемой кислоты не превышает 0,5масс. дол. Получение азотной кислоты более высокой концентрации требует иной технологии.
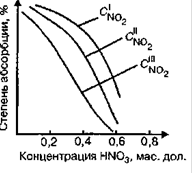
Рисунок 2 — Зависимость степени абсорбции NO2 от концентрации образующейся азотной кислоты Степень абсорбции оксида азота (IV) непосредственно связана с абсорбционным объемом аппаратуры. Повышение степени абсорбции требует, особенно, в конце процесса, значительного увеличения абсорбционного объема. Так, если степень абсорбции, равная 0,92 дол. ед., может быть достигнута при Vaб=22 м3/ т кислоты, то для повышения ее до 0,98 дол. единицы, то есть на 6,5% абсорбционный объем должен быть увеличен до 70 м3/т. (рис. 2.). Так как увеличение абсорбционного объема вызывает резкое возрастание капитальных затрат, то экономически более выгодно не добиваться степени абсорбции выше 0,98 дол. ед., а поглощать остатки оксида азота (IV) в отходящих газах щелочными поглотителями с последующим окислением образовавшегося нитрита натрия концентрированной азотной кислотой и возвращением оксида азота (II) в цикл (инверсия оксида азота (II)):
.
.
Реакция аммиака на платине начинается при 145 0С, но протекает с малым выходом NO и образованием преимущественно элементарного азота. Повышение температуры приводит к увеличению выхода окиси азота и росту скорости реакции. В интервале 700−1000 0С выход NO может быть доведен до 95−98%. Необходимый температурный режим процесса может поддерживаться за счет тепла реакций окисления. Для сухой аммиачно-воздушной смеси, содержащей 10% NH3, при степени конверсии 96% теоретическое повышение температуры газа составляет примерно 705 0С или около 700 0С на каждый процент аммиака в исходной смеси. Применяя аммиачно-воздушную смесь, содержащую 9,5% аммиака, можно за счет теплового эффекта реакции достигнуть температуры порядка 600 0С, для еще большего повышения температуры конверсии необходим предварительный подогрев воздуха или аммиачно-воздушной смеси. Следует учитывать, что подогревать аммиачно-воздушную смесь можно только до температуры не выше 150−200 0С при температуре греющего газа не более 400 0С. В противном случае возможна диссоциация аммиака или его гомогенное окисление с образованием элементарного азота.
Верхний предел повышения температуры контактного окисления аммиака определяется потерями платинового катализатора. Если до 920 0С потери платины в какой-то мере компенсируются ростом активности катализатора, то выше этой температуры рост потерь катализатора значительно опережает увеличение скорости реакции.
Применение повышенного давления при получении разбавленной азотной кислоты в основном связано со стремлением увеличить скорость окисления окиси азота и переработки образующейся двуокиси азота в азотную кислоту.
Термодинамические расчеты показывают, что и при повышенном давлении равновесный выход NO близок к 100%. Однако высокая степень контактирования в этом случае достигается лишь при большом количестве катализаторных сеток и более высокой температуре.
При выборе оптимального давления следует иметь в виду, что повышение давления приводит к росту потерь платины. Это объясняется увеличением температуры катализа, применением многослойных сеток и усилением их механического разрушения под действием большой скорости газа.
Для окисления аммиака обычно применяют воздух, поэтому содержание аммиака в смеси определяется содержанием кислорода в воздухе. При стехиометрическом отношении О2: NH3 = 1,25 выход окиси азота не значителен. Для увеличения выхода NO требуется некоторый избыток кислорода, следовательно содержание аммиака в смеси должно быть меньше 14,4%. В заводской практике содержание аммиака в смеси поддерживают в пределах 9,5−11,5%, что соответствует отношению O2: NH3 = 2: 1,7.
Суммарная реакция, определяющая потребность в кислороде при переработке аммиака в азотную кислоту NH3+2O2 = HNO3+H2O дает отношение O2: NH3 = 2, что соответствует содержанию аммиака в исходной смеси, равному 9,5%. Это говорит о том, что увеличение концентрации аммиака в смеси выше 9,5% в конечном итоге не приведет к росту концентрации NO, так как в этом случае в адсорбционную систему придется вводить дополнительный воздух.
Платиновые сплавы чувствительны к примесям, содержащимся в аммиачно-воздушной смеси. Предварительная очистка газов увеличивает продолжительность работы катализатора. Однако со временем катализатор постепенно отравляется и выход NO снижается. Для удаления ядов и загрязнений сетки периодически регенерируют посредством обработки их 10−15% раствором соляной кислоты.
Полная однородность аммиачно-воздушной смеси, поступающей в зону контактирования, является одним из основных условий получения высокого выхода окиси азота. Хорошее смешение газов имеет большое значение не только для обеспечения высокой степени контактирования, но и предохраняет от опасности взрыва. Конструкция и объем смесителя должны в полной мере обеспечивать хорошее перемешивание газа и исключать проскок аммиака отдельными струями на катализатор.
При понижении температуры и повышении давления газа равновесие реакции смещается вправо. При температурах ниже 200 0С и давлении 1 атм. окисление окиси азота может осуществляться почти на 100%, так что в этих условиях реакцию можно рассматривать как необратимую, протекающую в сторону образования азота. При температурах выше 700 0С происходит почти полная диссоциация NO2 на окись азота и кислород.