Энергетика химических реакций

Из второго закона термодинамики следует, что внутренняя энергия системы состоит как бы из двух частей: свободная энергия — та часть внутренней энергии, которая может быть использована для совершения работы, и связанная энергия — та часть внутренней энергии, которая не используется для совершения работы, а бесполезно рассеивается в виде тепла. Связанная энергия определяется энтропией S, которая… Читать ещё >
Энергетика химических реакций (реферат, курсовая, диплом, контрольная)
I. Значение темы Химическая термодинамика является теоретической основой химии. Она представляет собой математическую модель реальных систем, позволяющих решить вопрос о возможности протекания различных процессов. Знание термодинамических закономерностей позволяет получить представления об энергетическом балансе человеческого организма, установить специфические особенности преобразования одних видов энергии в другие в процессе жизнедеятельности. Полученные знания способствуют более глубокому усвоению многих разделов неорганической химии (химическая кинетика, химическое равновесие, учение о растворах), а также других химических и профильных дисциплин.
II. Теоретические сведения Тепловые эффекты являются важными характеристиками химических реакций. По их величинам можно судить о том, будет ли в течение реакции некая система нагреваться или охлаждаться и на сколько.
Химические процессы, протекающие в живых организмах, а также большинство химических реакций осуществляются в условиях постоянного давления (p = const). Энергия, которой обладает система, находящаяся при постоянном давлении (изобарный процесс) называется энтальпией.
Энтальпия — это сумма внутренней энергии системы и произведения объема на давление:
Энтальпия — это функция состояния и в термодинамических расчетах используют изменение энтальпии между конченым и начальным состоянием:
.
где Н1 — энтальпия начального состояния системы;
Н2 — энтальпия конечного состояния системы Если реакция экзотермическая, то энергия выделяется из системы, что ведет к уменьшению энтальпии, то есть Q>0, a ДH<0. Если реакция эндотермическая — тепло поглощается системой, то есть Q<0, a ДH>0. Таким образом, тепловой эффект реакции Q и энтальпия Н противоположны по знаку:
Из второго закона термодинамики следует, что внутренняя энергия системы состоит как бы из двух частей: свободная энергия — та часть внутренней энергии, которая может быть использована для совершения работы, и связанная энергия — та часть внутренней энергии, которая не используется для совершения работы, а бесполезно рассеивается в виде тепла. Связанная энергия определяется энтропией S, которая равна или:
(при постоянной Т).
Чем больше энтропия, тем больше количество связанной энергии, а чем больше в системе связанной энергии, тем более необратимым является процесс.
С точки зрения статистической термодинамики, энтропию можно рассматривать как меру беспорядка или наиболее вероятного состояния системы:
.
где W — вероятность существования вещества;
К — постоянная Больцмана:
.
где R — газовая постоянная;
NA — число Авогадро Энтропия также, как и энтальпия, является функцией состояния, то есть определяется начальным и конечным состоянием.
Энтальпийный и энтропийный факторы. Энергия Гиббса
Самопроизвольное направление реакции определяется действием двух факторов:
- 1) тенденцией системы к переходу в состояние с меньшей внутренней энергией (энтальпийный фактор);
- 2) тенденцией к достижению наиболее вероятного состояния, которое достигается переходом системы из более упорядоченного состояния в менее упорядоченное (энтропийный фактор).
Таким образом, движущая сила любого процесса определяется разностью энтальпийного и энтропийного факторов при постоянном давлении и температуре, и называется энергией Гиббса:
.
где.
Знак ДG определяет направление процесса. При ДG<0 процесс идет в прямом направлении, ДG>0, процесс идет в обратном направлении, ДG=0, условие термодинамического равновесия, при котором в системе не происходит ни энергетических изменений, ни меняется степень беспорядка.
Критерии направления самопроизвольно протекающих процессов
Из уравнения можно выявить критерии направления самопроизвольных реакций.
№ п/п. | Знак изменения функции. | Возможность самопроизвольного протекания реакции. | ||
ДН | ДS | ДG | ||
; | ; | Возможно при любых Т | ||
; | Невозможно при любых Т | |||
; | ; | ; | Возможно при низких Т | |
; | Возможно при высоких Т |
III. Вопросы для самоконтроля.
- 1. Что изучает химическая термодинамика?
- 2. Какими энергетическими эффектами могут сопровождаться химические реакции?
- 3. Какие процессы называются изохорными, изобарными, изотермическими?
- 4. Что характеризует внутренняя энергия и энтальпия?
- 5. Что называется теплотой образования, сгорания, разложения веществ?
- 6. Каким уравнением определяется энтальпия и ее изменение?
- 7. Какой закон является основным законом термохимии? Дайте его формулировку.
- 8. Перечислите следствия, вытекающие из закона Гесса.
- 9. Дайте определение понятия энтропия. Характер изменения энтропии. Единицы измерения. Уравнение Больцмана.
- 10. Как изменяется энтропия прямой и обратной реакции синтеза аммиака?
- 11. Сформулируйте второй закон термодинамики.
- 12. Какие значения принимает ДG при:
- а) наступлении состояния равновесия;
- б) реакции, протекающей в сторону образования конечных продуктов?
- 13. Возможно ли самопроизвольное протекание реакции, если при положительном значении ДS:
- а) ДН>0;
- б) | ДН|>|T•ДS |
IV. Задачи с эталонами решения.
Пример 1:
При сгорании 1 моль ацетилена в кислороде выделилось 1300 кДж теплоты. Определите теплоту образования ацетилена, если стандартные теплоты образовании СО2 (г) и Н2О (ж) равны 393,5 кДж/моль и 286 кДж/моль соответственно.
Решение:
Рассчитываем теплоту образования ацетилена по уравнению:
кДж Отсюда можно записать:

Отсюда находим:
кДж Ответ: Теплота образования С2Н2 равна 227кДж/моль.
Пример 2:
При горении формальдегида выделяется 561 кДж тепла. Вычислите теплоту образования формальдегида, если теплота образования СО2 равна 393,6 кДж/моль, а теплота образования Н2О (г) — 242 кДж/моль.
Решение:
По первому следствию из закона Гесса записываем:
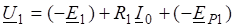
Ответ: Теплота образования формальдегида равна 74,6кДж.
Пример 3: Задача на закон Гесса Вычислить ДНр окисления этанола до уксусной кислоты:
.
если известно, что в организме эта реакция протекает в две стадии:
1).
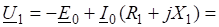
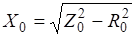
Решение:
Для решения нужного уравнения необходимо к первому уравнению прибавить второе и сократить подобные члены:
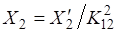
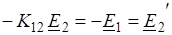
Пример 4:
Определите как изменится энтропия в следующей реакции:, полученный ответ подтвердите расчетами, если:
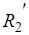
Решение:
ДS<0, так как в реакции число молей веществ, а газообразном состоянии уменьшается, значит энтропия тоже уменьшается (S1>S2).
По первому следствию из закона Гесса:
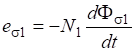
Пример 5:
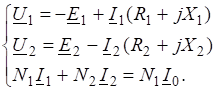
Рассчитаете ДG реакции, если, а. Возможна ли эта реакция в стандартных условиях?
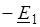
Решение:
Используем уравнение Гиббса:
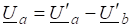
ДG<0, реакция идет в прямом направлении.
Пример 6:
Повлияет ли изменение температуры (повышение и понижение) на направление протекания реакции, если ДН<0, S>0. (Проанализируйте уравнение Гиббса).
Решение:
При условии ДН<0, а ДS>0 ДG<0 при любых температурах (при высоких и при низких температурах).
V. Задачи для самостоятельного решения.
1. Вычислите ДН0 реакций (см. приложение):
- 2. При сгорании 2 моль этилена в кислороде выделилось 2822кДж теплоты. Определите теплоту образования этилена, если стандартные теплоты СО2 и Н2О равны 393 кДж/моль и 286 кДж/моль соответственно.
- 3. Исходя из теплот реакций окисления As2O3 кислородом и озоном
Вычислите теплоту образования озона из молекулярного кислорода.
4. Не производя вычислений установите знак ДS0 следующих процессов:
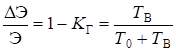
- 5. В каком из следующих случаев реакция возможна при любой температуре (проанализируйте уравнение Гиббса):
- а) ДН<0; ДS>0;
- б) ДН<0; ДS<0;
- в) ДН>0; ДS>0;
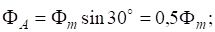
6. На основании значений и реагирующих веществ (см. приложение) вычислите ДG следующих процессов:
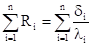
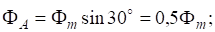
Укажите в каком направлении эти реакции будут протекать.
VI. Литература для самоподготовки.
- 1. Ю. А. Ершов, В. А. Попков и др. Общая химия. — М., 1993. — с. 10−21
- 2. Н. А. Глинка. Общая химия. — Л., 1979 и др. — гл VI, с. 166−170, 195−204.
- 3. А. С. Ленский Введение в бионеорганическую и биофизическую химию. — М., 1989. — с. 6−22
- 4. Лекции.