Сорбция как метод концентрирования

Где х — количество адсорбированного вещества, г; m — количество адсорбента, г; с — концентрация раствора при достижении равновесия; и n — постоянные величины, определяемые опытным путем. Постоянные для многих адсорбентов и адсорбируемых веществ колеблятся в пределах от 0,1 до 0,5. Константа зависит от природы адсорбируемого вещества и изменяется в широких пределах. Постоянные и можно определить… Читать ещё >
Сорбция как метод концентрирования (реферат, курсовая, диплом, контрольная)
Общие положения
Поверхностный слой на границе раздела фаз обладает избыточной энергией. Количественной мерой избытка энергии, отнесенной к единице площади поверхности, является поверхностное натяжение ?.
Накопление вещества на границе раздела фаз может происходить в результате адсорбции. Различают два случая адсорбции: адсорбцию на жидкой поверхности (границы раздела фаз: жидкость-газ и жидкость-жидкость)., адсорбцию на твердой поверхности (границы раздела фаз: твердое вещество-газ и твердое вещество-жидкость). Адсорбция на жидкой поверхности может быть вычислена по уравнению изотермы адсорбции Гиббса [1−5].
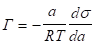
(1.1).
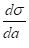
где — величина адсорбции, — активность адсорбируемого вещества, — изменение поверхностного натяжения раствора с активностью растворенного вещества.
Для достаточно разбавленных растворов вместо активности можно воспользоваться концентрацией.
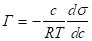
.(1.2).
Величина адсорбции зависит от природы поверхности адсорбента, природы адсорбата, его концентрации (давления), температуры и др. Графическая зависимость адсорбции от концентрации адсорбируемого вещества в объемной фазе при данной температуре называется изотермой адсорбции. Адсорбция из предельно разбавленных растворов или смесей газов подчиняется закону Генри:
или ,(1.3).
где и — константа Генри; с — концентрация адсорбата в объемной фазе; р — давление пара адсорбата.
Аналитическим выражением изотермы мономолекулярной адсорбции при более высоких концентрациях и на ровной поверхности является уравнение изотермы Ленгмюра:
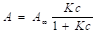
или ,(1.4).
где — предельная мономолекулярная адсорбция — емкость монослоя; К и — константы адсорбционного равновесия, характеризующие энергию адсорбции.
Для более точного определения величины, А предпочтительнее использовать уравнение Ленгмюра в линейной форме:
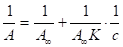
(1.5).
Графическая зависимость.
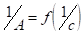
.
выражается прямой, пересекающей ось ординат. Отрезок, отсекаемый от оси ординат, определяет величину, обратную емкости монослоя. Тангенс угла наклона прямой позволяет найти константу адсорбционного равновесия К:
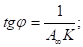
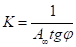
Часто для изучения сорбционных процессов используют эмпирическое уравнение Фрейндлиха.
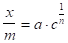
(1.6).
где х — количество адсорбированного вещества, г; m — количество адсорбента, г; с — концентрация раствора при достижении равновесия; и n — постоянные величины, определяемые опытным путем. Постоянные для многих адсорбентов и адсорбируемых веществ колеблятся в пределах от 0,1 до 0,5. Константа зависит от природы адсорбируемого вещества и изменяется в широких пределах. Постоянные и можно определить графически. Логарифмируя уравнение (1.6), получаем уравнение прямой.
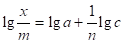
(1.7).
Определив значение при двух концентрациях и построив график в логарифмических координатах, определяют константы и n.
Для высоких давлений пара изотерма адсорбции описывается общим уравнением обобщенной теории Ленгмюра — уравнением полимолекулярной адсорбции БЭТ (Брунауэра, Эммета и Теллера):
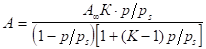
(1.8).
где K — константа, характеризующая энергию взаимодействия сконденсированного адсорбата с поверхностью адсорбента; - давление насыщенного пара адсорбата.
Для графического определения емкости монослоя используют линейную форму уравнения БЭТ:
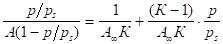
(1.9).
Строят изотерму адсорбции в координатах.
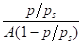
— .
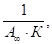
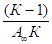
Отрезок, отсекаемый на оси ординат, соответствует величине, а тангенс угла наклона этой прямой равен. Из этих данных рассчитывают значение. Уравнение Ленгмюра и уравнение БЭТ широко используются для определения удельной поверхности адсорбентов, катализаторов и других дисперсных систем. Удельная поверхность sуд связана с емкостью монослоя соотношением.
(1.10).
где — число Авогадро; s0 — площадь, занимаемая одной молекулой адсорбата в насыщенном адсорбционном слое.
Для описания адсорбции на пористых телах с переходными порами (мезопористые адсорбенты) используют уравнение капиллярной конденсации Кельвина, которое позволяет определить размеры пор. Для сферичесикх частиц радиусом r,.
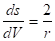
.
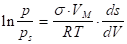
(1.11).
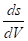
где и — давление насыщенного пара над поверхностью, имеющей кривизну, и над ровной поверхностью соответственно; - мольный объем вещества в конденсированном состоянии; Rуниверсальная газовая постоянная; - поверхностное натяжение; - кривизна поверхности.
Если тело в основном имеет микропоры, то применяют уравнение теории объемного заполнения микропор:
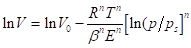
(1.12).
где 2 — объем заполненных пор при данном давлении;20 — общий объем пор в адсорбенте; - коэффициент аффинности, характеризующий природу адсорбата; Е — характеристическая энергия адсорбции; n — показатель степени, выражаемый целыми числами от 1 до 6.
Энергетические параметры адсорбции (изменение энтальпии, энтропии, энергии Гиббса) обычно рассчитывают из температурных зависимостей адсорбции. Например, из уравнений Клапейрона — Клаузиуса или Вант-Гоффа можно получить следующую теоретическую изостеру (А=const):
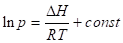
(1.13).
где Н — изменение энтальпии при адсорбции.
По экспериментально построенной зависимости в координатах уравнения (1.13) можно определить (по тангенсу угла наклона) дифференциальные мольные (изостерические) энтальпии адсорбции при данных степенях заполнения (при данных А).
Стандартная энергия Гиббса адсорбции связана с равновесной константой адсорбции К соотношением.
. (1.14).
Зная стандартную энтальпию и энергию Гиббса, легко вычислить стандартную энтропию адсорбции по уравнению.
.
Вещества, растворение которых приводит к снижению поверхностного натяжения водных растворов, называются поверхностно-активными (ПАВ).
Поверхностно-активные вещества отличаются высокой адсорбционной способностью, и для них Г. Это позволяет применительно к ПАВ совместно решить уравнения Гиббса и Генри, что дает линейную изотерму поверхностного натяжения при малых концентрациях ПАВ в растворе:
(1.15).
где 0 — поверхностное натяжение растворителя.
Принимая разность за поверхностное (двухмерное) давление, получим уравнение состояния идеального двухмерного газа:
(1.16).
где sM — поверхность, на которой распределен 1 моль ПАВ.
Совместное решение адсорбционного уравнения Гиббса (1.2) с уравнением Ленгмюра (1.4) для ПАВ дает уравнение Шишковского, связывающее изменение поверхностного натяжения раствора с концентрацией растворенного ПАВ в объеме:
(1.17).
Адсорбционная способность молекул ПАВ характеризуется поверхностной активностью. Дюкло и Траубе установили экспериментальное правило, согласно которому поверхностная активность жирных кислот, спиртов, аминов и других веществ в гомологических рядах на границе раствор — воздух возрастает в 3,2 раза при увеличении углеводородной цепи на каждую СН2 — группу. Это правило выполняется лишь для водных растворов ПАВ. Для растворов ПАВ в неполярных растворителях поверхностная активность при увеличении длины углеводородного радикала, наоборот, уменьшается (обращение правила Дюкло-Траубе).
Ленгмюр дал теоретическое обоснование эмпирическому правилу Дюкло — Траубе. Адсорбция и ориентация молекул ПАВ на границе фаз жидкость — воздух являются самопроизвольно протекающими процессами, сопровождающимися уменьшением энергии Гиббса системы. При введении ПАВ в полярную среду (воду) практически негидратирующиеся углеводородные цепи ПАВ раздвигают молекулы воды, встраиваясь в ее структуру. На осуществление этого требуется совершение работы против молекулярных сил. Обратный процесс — выход молекул ПАВ на межфазную поверхность (с ориентацией углеводородной цепи в сторону неполярной cреды) идет самопроизвольно с уменьшением энергии Гиббса системы, что соответствует работе адсорбции. Работа адсорбции зависит от длины углеводородной цепи ПАВ и в расчете на 1 моль молекул, состоящих из n числа СН2 -звеньев, составляет:
(1.18).
где — работа адсорбции, отнесенная к одной СН2 — группе.
Применительно к адсорбции из разбавленных растворов на основе уравнений Генри (1.4) и изотермы Вант-Гоффа можно получить следующее выражение для константы Генри КГ:
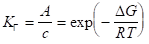
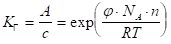
или (1.19).
Уравнение (1.19) показывает, что значение константы КГ с увеличением числа СН2 — групп в молекуле ПАВ растет в кратное число раз. Для двух соседних членов гомологического ряда ПАВ при условии постоянства концентрации и температуры можно записать:
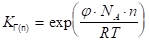
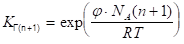
(1.20).
откуда.
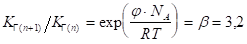
(1.21).
Полученное выражение для соотношения отражает правило Дюкло — Траубе.
Коэффициент равен 3,2 только при 200С. При повышении температуры его значение уменьшается, приближаясь в пределе к единице. Уменьшение константы обусловлено возрастанием десорбции молекул ПАВ при повышении температуры и снижением различия между поверхностной активностью гомологов.
Измерение поверхностной активности и адсорбции ПАВ позволяет определить параметры адсорбционных слоев: площадь, занимаемую одной молекулой, s0 и толщину поверхностного слоя. Величины s0 и рассчитывают по экспериментально найденным значениям предельной адсорбции, или определяют по изотермам адсорбции Г =, для построения которых вычисляют несколько значений. Для веществ с ярко выраженными поверхностно-активными свойствами величину адсорбции, А можно принять равной гиббсовской адсорбции Г (в молях на 1 м² поверхности).
Площадь s0, приходящуюся на одну молекулу в насыщенном адсорбционном слое, вычисляют по уравнению.
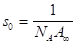
. (1.22).
Толщину адсорбционных слоев рассчитывают по формуле.
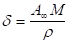
(1.23).
где М — молекулярная масса ПАВ; - плотность ПАВ.
Сопоставление вычисленных значений слоя с длиной ориентированных молекул дает возможность оценить тип поверхностной пленки и определить ориентацию молекул ПАВ в адсорбционном слое.