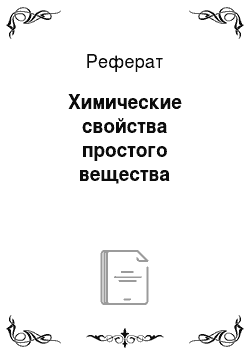
Вода, не содержащая кислорода, не действует на галлий даже при температуре кипения. Однако в присутствии кислорода, особенно в условиях автоклавной обработки при 300 °C галлий заметно окисляется:
4Ga + 2H2O + 3O2 = 4GaO (OH).
На воздухе при обычной температуре Галлий стоек. Выше 260 °C в сухом кислороде наблюдается медленное окисление (пленка оксида защищает металл). В серной и соляной кислотах галлий растворяется медленно, в плавиковой — быстро, в азотной кислоте на холоду галлий устойчив. В горячих растворах щелочей Галлий медленно растворяется. Хлор и бром реагируют с Галлием на холоду, иод — при нагревании. Расплавленный Галлий при температурах выше 300 °C взаимодействует со всеми конструкционными металлами и сплавами. Подобно алюминию, галлий обладает амфотерными свойствами. При растворении в щелочах образуются галлаты (например, Na[Ga (OH)4]). В горячих растворах щелочей галлий медленно растворяется:
2Ga + 6H2O + 6NaOH —> 3H2 + 2Na3[Ga (OH)6].
Галогены, за исключением иода, легко взаимодействуют с галлием уже на холоде:
2Ga + 3X2 = 2GaX3 (X = F, Cl, Br).
При нагревании галлий соединяется с серой:
2Ga + 3S = Ga2S3.
Галлий не реагирует с водородом и азотом, при нагревании в атмосфере аммиака выше 900° C дает нитрид:
2Ga + 2NH3 = 2GaN + 3H2.
Галлий медленно растворяется в разбавленных минеральных кислотах при невысоких температурах. В концентрированных кислотах или при повышенной температуре процесс растворения намного быстрее: К. А. Большаков Химия и технология редких и рассеянных элементов, ч.1, 1976. С. 226.
- 2Ga + 6HCl = 2GaCl3 + 3H2
- 2Ga + 6H2SO4 = Ga 2(SO4)3 + 3SO2+ 6H2O (при нагревании)
Ga + 4HNO3 = Ga (NO3)3 + NO+ 2H2O.