Общая и неорганическая химия

Химическое обменное взаимодействие ионов растворенной соли с водой, приводящее к образованию слабодиссоциирующих продуктов (молекул слабых кислот или оснований, анионов кислых или катионов основных солей) и сопровождающееся изменение рН среды, называется гидролизом. Соколов Р. С. Химическая технология: Учеб. пособие для студ. высш. учеб. заведений: В 2 т. М.: Гуманит. центр ВЛАДОС, 2003. Т. 1… Читать ещё >
Общая и неорганическая химия (реферат, курсовая, диплом, контрольная)
Общая и неорганическая химия
Задание 1.
Сколько граммов лимонной кислоты С6Н8О7 Н2О (Кд = 7,4 10-4) нужно добавить к 1 л винного сусла для понижения рН с 4,0 до 3,0? Считать, что концентрация водородных ионов зависит только от Кд по первой ступени.
Решение ион окисление молекулярный раствор Найдем начальную и конечную концентрацию ионов водорода в сусле при рН=4 и рН=3 по формуле.
pH = -lgСH+
При рН=4:
концентрация ионов в сусле равна СH+ =.
Количество ионов водорода в сусле:
n0H+ =.
При рН=3.
Концентрация ионов в сусле равна: СH+ =.
Начальное количество nH+ =.
Необходимо добавить ионов водорода.
моль Отсюда:
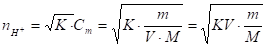
Следовательно:
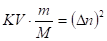
Отсюда:
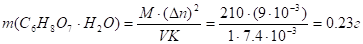
Задание 2.
В три пробирки, содержащие растворы хлорида цинка (II), добавили эквивалентных количествах: в первую — сульфид натрия, во вторуюкарбонат калия, в третью — воду. Составьте молекулярные и ионномолекулярные уравнения происходящих реакций. Укажите рН водных растворов продуктов реакций.
Решение.
Химическое обменное взаимодействие ионов растворенной соли с водой, приводящее к образованию слабодиссоциирующих продуктов (молекул слабых кислот или оснований, анионов кислых или катионов основных солей) и сопровождающееся изменение рН среды, называется гидролизом.
При сливании водных растворов различных солей возможны как ионно-обменые процессы так и процессы гидролиза. Если слить растворы двух солей, то идет совместный гидролиз двух солей то идет взаимное усиление гидролиза каждой из них, ибо ионы Н+ и ОН- образуют молекулу слабого электролита Н2О. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца.
1).
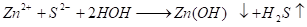
2).
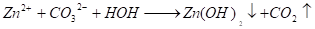
3) ZnCl2 + 2HOH Zn (OH)2 + 2HCl.
Zn2+ + 2Cl- + 2H-OH Zn (OH)2 + 2H+ + 2Cl-
Соль ZnCl2 образована слабым основанием и сильной кислотой.
ZnCl2
реакция не идет.
(1-я ступень) Образуется слабодиссоциирующий катион. Среда при гидролизе кислая рН меньше семи (во всех приведенных реакциях).
Молекулярное уравнение первой ступени гидролиза:
Гидролизом по второй ступени при обычных условиях можно пренебречь.
Задание 3.
Образуется ли осадок гидроксида свинца (II) (ПР =510-16), если к 0.1н раствору нитрата свинца добавить равный объем 0.4н раствора гидроксида натрия?
Решение.
При сливании двух разных объемов суммарный объем раствора увеличиться вдвое, а концентрация уменьшиться вдвое, следовательно концентрация раствора Pb (NO3)2 будет равна 0,05н, NaOH — 0,2н.
Pb2++ OH- Pb (OH)2
C учетом условия задачи находим произведения концентраций ионов:
ПР (Pb (OH)2)=[ Pb2+][ OH-]2=0,050,2=110-2
Сопоставляя полученное значение со значением произведения растворимости в условии задачи, видим, что рассчитанное произведение концентраций ионов превышает ПР (Pb (OH)2), следовательно раствор перенасыщен, и выпадает осадок.
Задание4.
Какую массу Ca (OH)2 и Na2CO3 надо добавить на каждый литр воды, чтобы снизить ее общую жесткость с 12 до 7 ммоль/л, а временную с 6 до 3,5 ммоль/л.
Решение.
Найдем массу смеси для того чтобы снизить общую жесткость:
m (Ca (OH)2,Na2CO3) =(Ж1ЧVЧМэ (Ca (OH)2, Na2CO3))-(Ж2ЧVЧ ЧМэ (Ca (OH)2, Na2CO3)),.
где Ж1— жесткость воды, ммоль-экв/л;
V-объем воды, л;
Мэ — молярная масса эквивалента, для устранения жесткости, г/моль.
Мэ (Ca (OH)2)=37 г/моль Мэ (Na2CO3)=53г/моль Отсюда:
m (Ca (OH)2,Na2CO3)=(12Ч1Ч (53+37))-(7Ч1Ч (53+37))=.
=1080 — 630=450мг=0,45 г Найдем массу смеси, чтобы снизить временную жесткость:
m (Ca (OH)2,Na2CO3)=(6Ч1Ч (53+37))-(3,5Ч1Ч (53+37))=540−315=.
=225мг=0,225 г Задание 5.
Две реакции протекают при 250С с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2, второй 2,5. Найдите отношение скоростей этих реакций при температуре 950С.
Решение В соответствии с правилом Вант-Гоффа найдем температурный коэффициент для скорости первой реакции:
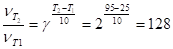
Скорость первой реакции увеличиться в 128 раз при увеличении температуры до 95 °C Найдем температурный коэффициент для скорости второй реакции:
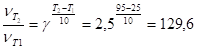
Скорость первой реакции увеличиться в 129,6 раз при увеличении температуры до 95 °C Задание 6.
В реакции между растворами иодида калия и пероксидом водорода в сернокислой среде, используемой при определении активных окислительных ферментов.
Решение.
H2O2 + H2SO4 + 2KI = 2H2O + I2 + K2SO4
H2O2 + 2H3O+ +2I- = 4H2O + I2
Уравнение. | Коэффициент. | Процесс. |
H2O2 + 2H3O + 2e- = 4H2O. | Окислитель (реакция восстановления). | |
2I — 2e- = I2 | восстановитель (реакция окисления). |
Задание 7.
В реакции между металлической медью и кислородом в присутствии углекислого газа и паров воды, являющейся причиной позеленения старинных медных изделий за счет образования карбоната дигидроксомеди (II).
Решение.
Cu2(CO3)(OH)22CuO+CO2+H2O.
Дигидроксокарбонат меди (II).
Уравнение электронного баланса составлять не надо, т. к ни один элемент не меняет степень окисления.
Задание 8.
В каких растворах восстановительная способность цинка выражена более сильно, если.
- а) Zn2+ + 2e = Zn Е0298 = -0,76 В
- б) Zn2+ + 2H2O + 2e = Zn + 4OH- Е0298=-1,26 В
Решение а) Zn2+ + 2e = Zn.
Восстановительная способность больше выражена в растворе сульфата медию Любой окислительновосстановительный процесс связан с переходом электронов от одних молекул или ионов к другим.
Zn (т) + CuSO4 (р-р) = ZnSO4 (р-р) + Сu (т) Электроны цинка переходят к ионам меди:
Zn° (т) + Сu+2 (р-р) = Zn+2 (р-р) + Сu° (Т) В данном случае протекают два взаимосвязанных процесса: окисление и восстановление. Окислением называют процесс потери электронов, приводящий к повышению степени окисления. Вещества, атомы или ионы которых отдают электроны называют восстановителями. Восстановитель, отдавая электроны, окисляется.
Zn° -2е > Zn+2
Восстановление — процесс присоединения электронов, приводящий к понижению степени окисления. Вещества, атомы или ионы которых присоединяют электроны называются окислителями. Окислитель, присоединяя электроны, восстанавливается.
Сu+2 + 2е > Сu0.
Общее число электронов, отданных восстановителем, равно числу электронов, принятых окислителем.
Также окислительно-востановительный потенциал цинка равен Е= -0,76 В, а Е== 0,34 В. Это говорит о том, реакция возможна.
б) Zn2+ + 2H2O + 2e = Zn + 4OH-, Е0298=-1,26 В взаимодействует с щелочами: при взаимодействии с водным раствором щелочи образуется комплексная соль цинковой кислоты (гидроксоцинкат натрия).
Zn + 2NaOH + 2H2O = Na2[Zn (OH)4] + H2
Zn0 — 2e- = 2Zn2+
2H2O + 2e- = H20 + 2OH;
Е= -1,26 В Е-= -0,414 В.
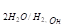
В данной реакции восстановительная способность больше выражена у цинка. Следовательно реакция возможна.
Задание 9.
Исходя из положения металлов в ряду напряжения и растворимости продуктов их взаимодействия с указанными ниже реагентами, определите в каком из приведенных реагентов — воде; уксусной, азотной, серной кислотах (различных концентраций); гидроксиде калия — происходит растворение металлов: меди (при стандартных условиях). Ответ подтвердите соответствующими уравнениями реакций.
Решение Медь располагается в ряду напряжения металлов после водорода, будет реагировать серной и азотной кислотой любой концентрации.
Реагирует с концентрированной холодной серной кислотой:
oксид меди (II).
С концентрированной горячей серной кислотой:
сульфат меди (II).
С безводной серной кислотой при 200 °C:
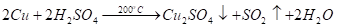
сульфат меди (I).
C разбавленной серной кислотой при нагревании в присутствии кислорода воздуха:
сульфат меди (II).
Реагирует с концентрированной азотной кислотой:
нитрат меди (II).
С разбавленной азотной кислотой:
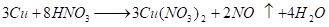
нитрат меди (II).
Используемая литература
- 1.. Глинка Н. Л. Общая химия. М.: Интеграл-пресс, 2002.
- 2. Коровин Н. В. Общая химия. М.: Высшая школа, 2002.
- 3. Суворов А. В., Никольский А. Б. Общая химия. СПб.: Химия, 2002.
- 4.. Соколов Р. С. Химическая технология: Учеб. пособие для студ. высш. учеб. заведений: В 2 т. М.: Гуманит. центр ВЛАДОС, 2003. Т. 1: Химическое производство в антропогенной деятельности. Основные вопросы химической технологии. Производство неорганических веществ.
- 5. Угай А. Я. Общая и неорганическая химия. М.: Высшая школа, 2000.