Оксиды.
Основные классы неорганических соединений

Слева направо по периоду по мере ослабления металлических свойств элементов основные свойства оксидов ослабевают, а кислотные возрастают. Сверху вниз по главным подгруппам неметаллические свойства элементов ослабевают, а металлические возрастают, при этом: сверху вниз по главной подгруппе возрастают основные свойства оксидов, а кислотные ослабевают. Если один и тот же элемент образует несколько… Читать ещё >
Оксиды. Основные классы неорганических соединений (реферат, курсовая, диплом, контрольная)
Определение: оксиды — сложные вещества, состоящие из 2-х элементов, один из которых кислород в степени окисления — 2.
Классификация. Оксиды разделяют на две группы: солеобразующие и несолеобразующие (индифферентные) (NO, CO, N2O, SiO); в свою очередь, солеобразующие делятся на кислотные, основные и амфотерные оксиды. а) кислотными называются оксиды, которым соответствуют кислоты (гидроксиды, обладающие кислотными свойствами); неметаллы в любой степени окисления и металлы в с.о. +5, +6, +7 образуют кислотные оксиды.
Примеры:
SO3 — H2SO4, CO2 — H2CO3, N2O5 — HNO3, Cl2O7- HClO4, CrO3- H2CrO4, Mn2O7 — HMnO4.
б) основными называются оксиды, которым соответствуют основания (гидроксиды, обладающие основными свойствами); металлы в степени окисления +1 и +2 образуют основные оксиды. Примеры:
Na2ONaOH, CaO — Ca (OH)2, MnO — Mn (OH)2, CrO — Cr (OH)2.
в) амфотерными называются оксиды, которые могут проявлять как кислотные, так и основные свойства. Примеры: Al2O3, Cr2O3, ZnO, BeO. Амфотерным оксидам соответствуют амфотерные гидроксиды (см. ниже).
Физические свойства оксидов.
Оксиды металлов — твердые вещества, имеющие различную окраску: большинство этих соединений не окрашены, CuO — черный Способы получения оксидов.
- а) горение простых веществ:
- 4P + 5O2 2P2O5 4Al + 3O2 2Al2O3
Дополнение.
С кислородом не взаимодействуют галогены, благородные газы, поэтому для получения оксидов этих элементов используют косвенные методы:
2HClO4 + P2O5 = Cl2O7 + 2HPO3.
реакция проводится на холод, т.к. оксид хлора (VII) термически неустойчивое вещество.
Азот реагирует с кислородом при 20 000С, при этом образуется оксид азота (II). Для получения высшего оксида азота используют оксид фосфора (V):
2HNO3 + P2O5 = N2O5 + 2HPO3.
Металлы взаимодействуют с кислородом так:

Особенности:
- 2Na+O2>Na2O2
- 2K+O2>K2O2(KO2)
- 3Fe+2O2>Fe3O4 (сгорание)
- б) горение и обжиг сложных веществ:
CH4 + 2O2 CO2 + 2H2O 2ZnS + 3O2 2ZnO + 2SO2.
- в) разложение сложных веществ:
- — карбонатов (нерастворимых)
BaCO3BaO + CO2.
- — сульфатов (кроме сульфатов натрия и калия)
- 2CuSO4 2CuO + 2SO2 + O2
- — Дополнение. Схема «Разложение нитратов»
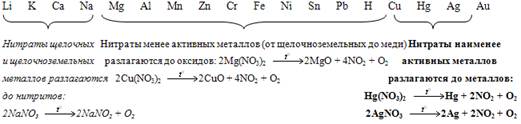
Исключения и дополнения:
4LiNO3 = 2Li2O + 4NO2 + O2.
Mn (NO3)2=MnO2 + 2NO2.
2Fe (NO3)2=2Fe2O3 + 8NO2 + O2.
NH4NO3 N2O + 2H2O NH4NO2 N2 + 2H2O.
Химические свойства основных оксидов:
а) взаимодействие с водой.
Правило: оксид взаимодействует с водой, если продукт реакции растворим в воде (и наоборот).
Примеры:
Na2O + H2O 2NaOH.
FeO + H2O реакция не идет, т.к. Fe (OH)2 нерастворим в воде.
б) взаимодействие с кислотами.
При взаимодействии основных оксидов с кислотами образуется соль и вода.
Примеры:
CuO + H2SO4 CuSO4 + H2O (требуется нагревание) Обратить внимание на следующее:
кремниевая кислота не реагирует с основными оксидами («твердое» не реагирует с «твердым»).
если в оксиде с.о. металла не максимальная, то в реакциях с кислотой азотной любой концентрации и с концентрированной серной кислотой помимо обменного взаимодействия возможно окислительно-восстановительное:
- * FeO + 4HNO3(конц) Fe (NO3)3 + NO2 + 2H2O
- * 2FeO + 4H2SO4 (конц) Fe2(SO4)3 + SO2+ 4H2O
если кислота многоосновная, то возможно образование кислых солей.
- *CaO + 2H3PO4 Ca (H2PO4)2 + H2O
- в) взаимодействие с кислотными оксидами.
Эти реакции протекают при нагревании, в ходе реакции образуется соль:
CaO + CO2 = CaCO3.
Примечание:
уравнения реакций в пунктах 6б и 6 В являются доказательством основных свойств оксидов г) взаимодействие с амфотерными оксидами.
Na2O + Al2O3 2NaAlO2 (при нагревании).
Na2O + ZnONa2ZnO2 (при нагревании) Химические свойства кислотных оксидов:
а) взаимодействие с водой. Правило: оксид взаимодействует с водой, если продукт реакции растворим в воде (оксид не взаимодействует с водой, если продукт реакции нерастворим в воде) Все кислотные оксиды, кроме SiO2, реагируют с водой.
Примеры:
P2O5 + 3H2O 2H3PO4 (при нагревании).
*P2O5 + H2O HPO3 (на холоду).
SiO2 + H2O реакция не идет, т.к. H2SiO3 нерастворима в воде.
- б) взаимодействие с основными и амфотерными оксидами (см. пункт 6. в)
- г) взаимодействие с основаниями. Правило: кислотные оксиды взаимодействуют со щелочами, при этом образуется соль и вода. Пример:
- 2NaOH + CO2 Na2CO3 + H2O (в избытке NaOH)
NaOH + CO2 NaHCO3 (в избытке CO2).
- д) взаимодействие с солями. Правило:
- — при нагревании менее летучий оксид вытесняет из соли более летучий оксид.
Пример:
Na2CO3 + SiO2 Na2SiO3 + CO2 (при нагревании).
- — в растворе оксид, соответствующий более сильной кислоте, вытесняет из соли оксид, соответствующий более слабой кислоте.
- — оксиды могут взаимодействовать с солями, содержащими остаток кислоты, которой этот оксид соответствует:
Na2CO3 +CO2 + H2O 2NaHCO3.
Na2SO3 +SO2 + H2O 2NaHSO3.
Пример:
Na2SiO3 + CO2 Na2CO3 + SiO2 (в растворе) Химические свойства амфотерных оксидов.
- а) амфотерные оксиды не реагируют с водой
- б) амфотерные оксиды в реакциях с кислотами проявляют основные свойства, т. е. реакции протекают так же, как с основными оксидами
Пример:
Al2O3 + 6HCl 2AlCl3 + 3H2O.
в) взаимодействие со щелочами. В зависимости от условий реакции протекают по-разному:
Al2O3 + 2NaOH + 3H2O 2Na[Al (OH)4] (в растворе).
Al2O3 + 2NaOH 2NaAlO2 + H2O (при нагревании).
- г) взаимодействие с основными оксидами (см № 6г)
- д) при взаимодействии с кислотными оксидами амфотерные оксиды проявляют основные свойства.
Пример:
Al2O3 + P2O5 2AlPO4.
е) При взаимодействии с солями амфотерные оксиды, как нелетучие, вытесняют из солей при нагревании более летучие оксиды.
Пример:
Na2CO3 + Al2O3 2NaAlO2 + CO2.
оксид. | Гидроксид, основная форма. | Гидроксид, кислотная форма (при нагревании). | Гидроксид, кислотная форма (в растворе). |
BeO. | Be (OH)2. | H2BeO2. | H2[Be (OH)4]. |
ZnO. | Zn (OH)2. | H2ZnO2. | H2[Zn (OH)4]. |
SnO. | Sn (OH)2. | H2SnO2. | H2[Sn (OH)4]. |
PbO. | Pb (OH)2. | H2PbO2. | H2[Pb (OH)4]. |
Al2O3. | Al (OH)3. | HAlO2. | H[Al (OH)4]. |
Cr2O3. | Cr (OH)3. | HCrO2. | H3[Cr (OH)6]. |
Fe2O3. | Fe (OH)3. | HFeO2. | H3[Fe (OH)6]. |
Примечание: кислотная форма амфотерных гидроксидов составлена формально, т.к. в реакциях со щелочами и с основными оксидами могут быть образованы только соли приведенных форм гидроксидов.
Зависимость кислотно-основных свойств оксидов от положения элемента в периодической системе и его степени окисления.
Слева направо по периоду по мере ослабления металлических свойств элементов основные свойства оксидов ослабевают, а кислотные возрастают. Сверху вниз по главным подгруппам неметаллические свойства элементов ослабевают, а металлические возрастают, при этом: сверху вниз по главной подгруппе возрастают основные свойства оксидов, а кислотные ослабевают. Если один и тот же элемент образует несколько оксидов с разными степенями окисления, то чем выше степень окисления элемента в оксиде, тем выше его кислотные свойства.
Пример:
Cr+2O — основный оксид,.
Cr2+3O3 — амфотерный оксид,.
Cr+6O3 — кислотный оксид.
Особенные свойства некоторых оксидов.
1) смешанный оксид, оксид железа (II, III).
Fe3O4 = FeO•Fe2O3.
Получение:
- 3Fe + 4O2 Fe3O4 (FeO•Fe2O3)
- 3Fe + 4H2O Fe3O4 (FeO•Fe2O3) + H2
Химические свойства.
Fe3O4 (FeO•Fe2O3) + 8HCl = FeCl2 + 2FeCl3 + 4H2O.
Fe3O4 (FeO•Fe2O3) + 4H2SO4(разб) = FeSO4 + Fe2(SO4)3 + 4H2O.
Fe3O4 (FeO•Fe2O3) + 10HNO3(конц.) = 3Fe (NO3)3 + NO2 + 5H2O.
2Fe3O4 (FeO•Fe2O3) + 10H2SO4(конц.) = 3Fe2(SO4)3 + SO2 + 10H2O.
Fe3O4 (FeO•Fe2O3) + O2 Fe2O3.
2). Оксид серы (IV), сернистый газ.
Получение:
В лаборатории.
Na2SO3 + 2HCl = 2NaCl + SO2 + H2O.
В промышленности.
4FeS2 + 11O2 = 2Fe2O3 + 8SO2 (обжиг пирита) Проявляет окислительные и восстановительные свойства (в большей мере характерны восстановительные) а) SO2 — окислитель.
SO2 + 2H2S= 3S + 2H2O.
- б) SO2 — восстановитель
- 2SO2 + O2 -2SO3 (катализатор V2O5)
SO2 + Br2 + 2H2O = H2SO4 + 2HBr.
3). Оксид фосфора (V) P2O5.
Сильное водоотнимающее средство:
P2O5 + 2HClO4 = Cl2O7 + 2HPO3.
- 4). SiO2 — единственный кислотный оксид, который взаимодействует с плавиковой кислотой:
- 4HF + SiO2 = SiF4^ + 2H2O
SiO2 + 2Mg 2MgO + Si (в избытке магния протекает такая реакция: SiO2 + 4Mg 2MgO + Mg2Si).
4). Оксиды металлов взаимодействуют с металлами. Правило: более активный металл вытесняет из оксида менее активные металл (металл, стоящий левее, а ряду активности, вытесняет металл, стоящий правее него).
CuO + Mg MgO + Cu.
MgO + Cu — реакция не идет.
- 5). Оксид углерода (II) — угарный газ, сильный восстановитель
- 2СО + О2 = 2СО2
Fe2O3 + 3CO 2Fe + 3CO2.
CO + Cl2 COCl2 (фосген).
6). Оксид углерода (IV) — углекислый газ.
В атмосфере горит магний.
CO2 + 2Mg = 2MgO + C.
7). Оксиды азота NO, NO2.
N2 + O2 2NO. Оксид азота (II) легко окисляется кислородом воздуха: 2NO + O2 2NO2.
Оксид азота (IV) является кислотным оксидом, он соответствует двум кислотам — азотной и азотистой:
- 2NO2 + H2O = HNO2 + HNO3
- 2NO2 + 2KOH = KNO2 + KNO3+ H2O
- 8). Оксид хрома (VI) — кислотный оксид, сильный окислитель
CrO3(нед) + H2O H2CrO4 хромовая кислота.
- 2CrO3(изб.) + H2O H2Cr2O7 двухромовая кислота
- 6HCl + CrO3 3Cl2 + CrCl3 + 3H2O