Лекция № 5. Особенности измерения электропроводности в ультраразбавленных растворах

Электроды сравнения и измерения Основным электродом сравнения, как мы говорили, является водородный электрод. Однако этот электрод очень чувствителен к изменению условий среды, что сильно усложняет работу с ним. Поэтому на практике для определения потенциала некоторого электрода, этот электрод соединяют в электро химический элемент не с водородным, а с другим электродом сравнения, потенциал… Читать ещё >
Лекция № 5. Особенности измерения электропроводности в ультраразбавленных растворах (реферат, курсовая, диплом, контрольная)
Такие растворы и такая задача имеет место при измерении электропроводности химически обессоленной воды на ХВО ТЭС и при химконтроле за водным режимом на ТЭС.
Особенности измерения в ультраразбавленных растворах:
1. Непостоянство «постоянной» ячейки «К».
Дело в том, что с уменьшением концентрации электролита уменьшаются рабочие поверхности электродов датчика, т.к. происходит рассеяние силовых линий на краях пластин-электродов, что ведет к увеличению К. Наоборот, с увеличением концентрации раствора от бесконечно разбавленных, напряженность электрического поля между электродами возрастает, К уменьшается до некоторого постоянного значения и при дальнейшем увеличении концентрации краевое рассеяние перестает заметно сказываться, остается К=const.
Для устранения эффекта рассеяния электрического поля и изменения «К» датчика электроды выполняют либо в виде коаксиальных цилиндров, либо в виде оснований цилиндра, а края обязательно изолируют.
2. Учет электропроводности воды
При определении постоянной датчика и вообще при измерениях в ультраразбавленных растворах, следует помнить, что истинная величина удельной электропроводности раствора элемента равна разности между измеряемой удельной электропроводностью и уд. электропроводностью воды:
.
(Н2О=Н+(аН++ОН-)10-3. При t=25оС и рН=7 Н2О0,5510-7 Ом-1см-1).
Т.к. здесь воды соизмерима с изм постоянная датчика К определяется в этом случае так:
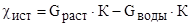
;
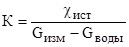
.
где G — общая электропроводность, Ом-1 (сименс).
Кондуктометрический анализ.
Использования метода измерения электропроводности растворов электролитов для кондуктометрического анализа не требует определения постоянной датчика и заключается в следующем. В процессе аналитической реакции (например нейтрализации) определяется общая электропроводность раствора электролита G. Точка эквивалентности при титровании соответствует изменению угла наклона прямой (излому), построенной в координатах G (Ом) — Vдоб (мл). Например, при титровании сильной кислоты щелочью идут реакции HClH++Cl-
NaOHNa++OH-,.
H++OH-H2O.
При приближении объема добавленного NaOH к 100% от эквивалентного, электропроводность анализируемого раствора резко уменьшается, т.к. резко уменьшается концентрация подвижных ионов H+. При добавлении NaOH сверх 100%, т. е. точкой эквивалентности электропроводность раствора возрастает, но менее интенсивно, т.к. появляющиеся в избытке ионы ОН- обладают меньшей подвижностью, чем Н+.
График кондуктометрического титрования НСl раствором NaOH выглядит следующим образом:
Точка излома прямой на графике отвечает точке эквивалентности.
Таким образом, измеряя электропроводность раствора определяют точку эквивалентности (точку конца титрования) в тот момент, когда G перестает падать и начинает расти.
Кондуктометрический метод анализа находит широкое применение при титровании разбавленных растворов, обычное титрование которых, в силу малой величины скачка титрования, приводит к существенным ошибкам. Кроме того, кондуктометрический метод используется при титровании окрашенных или мутных растворов.
Явления на границе раздела металл-раствор электролита
В этом разделе будут рассматриваться процессы происходящие при погружении металла в воду или водный раствор. Представим себе, что пластина какого-либо металла, например железа, опущена в воду. Ионы железа в результате действия сильно полярных молекул воды, отрываясь от металла, начнут переходить в слой воды, прилегающей к поверхности пластинки.
Возникающее вследствие этого электростатическое притяжение между ионами, перешедшими в раствор, и противоположно заряженной пластинкой металла препятствует дальнейшему течению этого процесса, и в системе устанавливается равновесие.
Равновесие описывается уравнением:
МеМеn++ne.
Подобное взаимодействие происходит при погружении металла не только в чистую воду, но и в раствор. Если металл (Ме) погрузить в раствор соли этого металла Ме Ас (например, Zn в раствор ZnSO4), то также как и в чистой воде, будет происходить выход ионов Меn+ в раствор. Однако равновесие установится быстрее, меньше ионов металла выйдут в раствор, чем в чистой воде, т.к. в растворе уже есть ионы металла соли МеАс. Даже возможен случай, когда ионы Меn+ будут выделяться на поверхности металла из рарствора, и поверхность металла будет заряжаться положительно.
Электрическое поле, создаваемое зарядом металла в растворе вызывает неравномерное растпределение ионов в растворе вблизи металла. Если металл заряжен отрицательно, то катионы, притягиваясь металлом, концентрируются у его поверхности. Анионы же, наоборот, отталкиваются и уходят из этого слоя. В результате раствор вблизи металла приобретает заряд, противоположный по знаку заряду металла. Образуется двойной электрический слой. Он характеризуется скоплением электронов на поверхности металла и катионов в растворе вблизи поверхности. Дв. электрический слой связан с возникновением определенной разности потенциалов (скачки потенциала) на поверхности раздела: металл-раствор. Часть двойного электрического слоя, относящаяся к раствору, называется диффузным слоем, т.к. он размывается по мере удаления от поверхности металла.
Таким образом, при погружении металла в воду или в раствор, содержащий ионы металла, на поверхности раздела: металл/раствор образуется двойной электрический слой и возникает разность потенциалов (скачок потенциала) между металлом и раствором.
Электрохимические элементы и цепи. Их обратимость.
Рассмотрим систему, в которой не один, а два каких-нибудь металла. Например цинк и медь, в виде пластинок опущены в растворы своих солей, разделенные диафрагмой. Каждый из металлов может выделить в раствор то количество ионов, которое отвечает равновесию его с раствором. Однако, отвечающие такому равновесию потенциалы этих металлов неодинаковы. Цинк обладает более высокой способностью выделить ионы в раствор, чем медь, и поэтому приобретает более высокий отрицательный заряд. Если пластинки соединить проводником первого рода (проволокой), то разница потенциалов пластин цинка и меди приведет к переходу части электронов с цинковой пластины на медную, а гальванометр, включенный во внешнюю цепь покажет наличие тока. Этот процесс (ток во внешней цепи) нарушает равновесие двойного слоя на обеих пластинах, а на цинковой пластине дополнительно выделится в раствор некоторое количество ионов цинка по реакции: ZnZn2++2e, а на медной пластине разрядится соответствующее число ионов меди по реакции: Cu2++2eCu.
Таким образом, вновь появится разность потенциалов пластин Zn и Cu и вновь пойдет эл. ток во внешней цепи. Т. е. возникнет самопроизвольный процесс, при котором цинковая пластина растворяется, а на медной разряжаются ионы Cu2+ и выделяется металлическая медь.
Гальванический элемент, рассмотренный нами называется элементом Даниэля (предложен в середине прошлого века).
То есть электрохимическим (гальваническим) элементом называется устройство, позволяющее получить электрический ток за счет проведения электрохимической реакции. Несколько электрохимических элементов, соединенные последовательно, образуют электрохимическую цепь элементов.
Если при прохождении электрического тока в разных направлениях на поверхности электродов протекает одна и та же хим. реакция, но в противоположном направлении, то такие электроды, а также элемент, или цепь, называются обратимыми. Примером обратимого элемента является рассмотренный элемент Даниэля.
Если к собранному элементу приложить внешнюю ЭДС, направленную противоположно и равную по величине ЭДС элемента Даниеля, то тока во внешней цепи не будет, система будет находиться в равновесии.
а) Если ЕZn/Cu>Eвнешн. на бесконечно малую величину, то на электродах в прямом направлении протекают реакции:
Zn: ZnZn2++2е.
Cu: Cu2++2eCu.
б) Если ЕZn/Cuвнешн. на бесконечно малую величину, то на электродах в обратном направлении протекают теже реакции, но в противоположном направлении:
Zn: Zn+2еZn.
Cu: CuCu2++2е Здесь обратимое направление процессов может быть вызвано путем пропускания тока бесконечно малой величины от внешнего источника Евнешн.
Примером необратимого элемента может служить элемент Вольта. В прямом направлении идут реакции:
Zn: ZnZn2++2е.
Cu: 2Н++2еН2
в обратном (при Евнешн>ЕZn/Cu).
Zn: :2Н++2еН2
Cu: CuCu2++2е то есть совсем другие химические реакции.
ЭДС элемента (цепи), знак ЭДС.
Наибольшая разность потенциалов данного элемента, возникающая в обратимых условиях его работы (Евнеш=Евнутр), называется электродвижущей силой элемента (ЭДС). Т. е. в условиях, когда во внешнюю цепь элемента включена ЭДС равная по величине и противоположная по знаку ЭДС данного элемента.
В основе всякого гальванического элемента (цепи) лежит окислительно-восстановительная реакция, проводимая так, что на отрицательном электроде (аноде) происходит окисление (Zn), а на положительном электроде (катоде) — восстановление (Cu).
ЭДС гальванического элемента имеет положительный знак для элемента, способного работать самопроизвольно, т. е. при самопроизвольном протекании реакций на аноде и катоде.
ЭДС гальванической цепи, записанной для обратного направления самопроизвольной электродной реакции, имеет отрицательный знак. Он показывает, что элемент может работать, лишь когда данная реакция осуществляется в направлении, противоположном указанному в записи цепи. При этом элемент будет обладать той же ЭДС, но знаки электродов будут обратными. Такая реакция может осуществляться лишь путем приложения противоположной внешней ЭДС, т. е. путем электролиза.
Форма записи гальванических цепей принята такая. Для гальванического элемента Даниэля:
(-) CuZnZnSO4CuSO4Cu (+).
Пк П- Пд П+
для элемента Вольта:
(-) CuZnН2SO4Cu (+).
Все фазы, составляющие элемент, записываются подряд в одну строку и отмечаются все имеющиеся поверхности раздела. Чтобы правильно отразить наличие контактной разности потенциалов, т. е. показать, что цепь — замкнутая на внешний гальванометр, принято при записи на обоих концах указывать одинаковые металлы (Cu).
Пк — контактная разность потенциалов (измеряемая гальванометром во внешней цепи); Пд — разность потенциалов на границе раздела растворов ZnSO4 и CuSO4.
Пд — разность потенциалов на границе раздела растворов ZnSO4 и CuSO4 (диффузный потенциал).
П+, П- — электродные потенциалы катода и анода.
Эдс цепи равна:
Е=П++П-+Пк+Пд
ЭДС электрического химического элемента (цепи) считается положительной, если катионы при работе элемента проходят в растворе от электрода, записанного в схеме слева, по направлению к электроду записанному в схеме справа, и в этом же направлении движутся во внешней цепи электроны. При этом правый электрод заряжен положительно относительного левого. Если схема записана так, что движение катионов в электролите и электронов во внешней цепи происходит справо налево, то ЭДС такой цепи отрицательна.
Измерение ЭДС электрического. химического элемента.
Основано на компенсационном методе (рис.), позволяющем определить ЭДС в условиях обратимой работы элемента, т. е. при минимально возможном прохождении тока.
Внешний источник тока © с известной ЭДС, например, аккумулятор, замкнут на реостат АВ. Элемент, ЭДС которого определяют, включают к точке (А) и скользящему контакту (Д), навстречу ЭДС внешнего источника. Перемещая контакт Д, устанавливают его на реостате так, чтобы ток в цепи, А к Д был равен 0. Это означает, что падение потенциала вдоль реостата на участке АД точно равно ЭДС измеряемого элемента (Ек). Т. е. UАД=Ек. Т.к. UАВ=Евнешн.=Ес, а UАВ/UАД=RАВ/RАД, то.
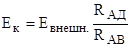
.
При измерениях ЭДС эл. хим. элементов, как показано, необходимо иметь «внешний элемент» с хорошо известной устойчивой ЭДС. Для этой цели обычно применяют нормальный элемент (или элемент Венстона). В нем отрицательный электрод представляет собой амальгаму кадмия, помещенный в насыщенный раствор CdSO4, в присутствии кристаллов CdSO48/3Н2О. Положительный электрод представляет собой пасту из ртути и Hg2SO4, помещенную также в насыщенный раствор CdSO4 с кристаллами CdSO48/3Н2О.
При работе такого элемента протекает следующая окислительно-восстановительная реакция (суммарная):
Cd+Hg2SO4+8/3H2OCdSO48/3H2O+2Hg.
Или отдельно, катод: 2Hg++2e2Hg (ж) анод: Cd-2eCd2+
При кратковременных замыканиях нормальный элемент работает вполне обратимо и устойчиво. ЭДС его при t=20оС равна Ен.э.=1,0183 В. Включая нормальный элемент, как показано выше, измеряют ЭДС анализируемого элемента по формуле: Е=Ен.э.RАД/RАВ.
Термодинамика электрохимических процессов
В разделе химическая термодинамика установили, что для обратимых термодинамических процессов, протекающих при Т=const и Р=соnst, работа, совершаемая системой, является максимально полезной работой.
А=Апол, которая, в свою очередь, равна изменению изобарно-изотермического потенциала:
Апол=-Z.
Применим названные условия для эл. хим. элемента. Тогда получим, что для обратимого элемента, в котором протекает окислительно-восстановительная реакция и совершается полезная работа при при Т=const и Р=соnst, справедливо уравнение (1). При этом работа, совершаемая элементом, равна произведению ЭДС на количество переносимого электричества (для превращения в реакции 1 г-атома вещества).

,
где nзаряд иона; F — число Фарадея, F=96 500 кул.; Е — ЭДС элемента, В.
Из формулы (2) следует, что
- а) ЭДС элемента характеризует максимальную полезную работу, которая может быть совершена системой при протекании в ней данной химической реакции;
- б) ЭДС обратимого элемента может служить мерой изменения изобарно-изотермического потенциала в реакции, совершающейся при работе элемента.
Если F — выражается в Кулонах, то Апол и Z получаются в джоулях Апол=-Z=96500nE
Если в электрохимическом элементе протекает окислительно-восстановительная реакция:
аА+вВсС+dД.
А уравнение изотермы такой химической реакции имеет вид:
,
где Ка — константа равновесия реакции при выражении концентраций веществ через их активности; i — стехиометрический коэффициент iой компонты (а, в, с, d); аi — активность i-го реагирующего вещества (А, В, С, Д). Для реакции (а) получим:

,
где ilnai=-alnaa-вlnaB+clnac+dlnaд
Подставляя (-Z) из уравнения (2) и выражая Е, получим:
.
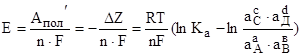

Величина при постоянных р иТ.

Обозначим, тогда получим для обратимого элемента:

,
где Ео — называется нормальной (или стандартной) ЭДС элемента.
Стандартными условиями называется состояние, когда аа=ав=ас=ад=1, т. е. активности всех реагирующих веществ равны 1. (Ео=Е при аi=1).
Уравнение (4) выражает ЭДС обратимого элемента от активностей в растворе веществ, участвующих в химической реакции.
В частности для элемента Даниэля (Якоба) имеем:
Реакция в элементе: Zn+Cu2+Zn2++Cu
Учитывая, что работа выхода (Авых) электрона для цинка и меди практически одинакова и активности твердых Zn и Cu постоянны, получим

,
а ЭДС гальванической цепи:

,

где .
Так как при при 25оС Е0 этого элемента Е0=1,1036, то из уравнения (2) для нормальных условий имеем:
-Zo=nFE0 т. е. -Zo=2 230 611,103=50,88 (ккал).

Из уравнения (7) .
Ка=21037; R=0,1 987; Т=298К Т.к. константа равновесия для реакции (б) равна Ка=21037, то видно, что в данной реакции равновесие очень сильно смещено вправо (ZnZn2+).
Электродные потенциалы. Зависимость скачка потенциала от концентрации электролита а) Зависимость (скачка потенциала) от концентрации электролита Электрохимический элемент состоит из двух полуэлементов или из двух электродов. При соприкосновении каждого такого электрода с раствором на границе раздела металл (электрод) — раствор электролита возникает двойной электрический слой.
В металле:
Cu (металл)=f (T и состава металла). Для данной пластины Cu (металл)=const при Т= const.
В растворе:
Cu2+=f (T и аCu2+)
Пусть Cu (р-р)Cu (мет), то будет происходить переход ионов Cu2+ на твердую металлическую поверхность пластины, а в растворе будет избыток ионов SO4, т. е. пластина будет заряжена положительно, а раствор отрицательно. При переходе из исходного состояния в состояние равновесия, разность хим. потенциалов меди в растворе и на поверхности будет определять скачок потенциала двойного электрического слоя по формуле:

при Т = const; Р= const; Z=ni=Сг2+(-1)+Сu1=-(Сг2+-Сu)

зависит от аCu2+, то изменяя концентрацию Сu2+ в растворе, можно получить на поверхности пластины противоположный заряд, соответствующий переходу ионов меди из металла в раствор. В этом случае: Cu (металл) Cu (р-р).
Можно подобрать такую концентрацию Сu2+ в растворе, когда: Cu (металл)=Cu (р-р) и заряд на электроде будет равен нулю. Такие растворы называются нулевыми растворами.
Пластина меди помещается в чистую воду при Т=const, Р= const. Далее в воду добавляют соль CuSO4 и постепенно увеличивают СCu2+ в растворе.
1. Термодинамическая характеристика процесса в начальный момент (чистая вода).
Идет переход ионов Cu2+ в раствор. Образуется двойной электрический слой со скачком потенциала на границе. Процесс идет до установления равновесия. Переход из исходного состояния в равновесное идет самопроизвольно и может быть оценен изменением Z (Z). При Т=const и Р= const Z=ini. Реакция CuCu2++2e
Здесь ini=CuonCuo+Cu2+nCu2+
Т.к. идет растворение меди, то nCuo0; nCu2+0
Пусть реакция прошла в количестве 1 г-атом. Тогда nCuo=-1; nCu2=+1 и ini=-Cuo+Cu2+
Однако для обратимых процессовZ=Апол=nF, тогда в данном случае получим: -Z=-(-Cuo+Cu2+= nF; =1/nF (Cuo-Cu2+)
Значение соответствует i — противодействует дальнейшему растворению.
Если увеличить концентрацию железа в растворе (добавка CuSO4), то будет идти увеличение Cu2+, т.к. i=oi+RTlnai, при Cuoconst, тогда при некотором СCu2+ наступит момент, когда Cuo-Cu2+=0, т. е Cuo=Cu2+.
В этом случае =0. Это нулевые растворы.
Согласно Нернсту ЭДС элемента из двух отдельных электродов равна: Е=1-2. При этом, если соединить в электрохимических элемент два электрода, находящиеся в нулевых растворах, то ЭДС не будет равна 0. То есть нулевые растворы нельзя рассматривать как растворы с абсолютными нулями потенциалов. (нарушается равенство Сu=Сu2+)
б) Величина и знак электродного потенциала Практически потенциалы электродов определяют не в абсолютном виде, т.к. нельзя измерить отдельного электрода, а относительно некоторого электрода, который принят за стандартный (нормальный). В качестве такого электрода сравнения принят нормальный водородный электрод. (Состоит из черняной платины (подкладка), помещенной в раствор, содержащий ионы Н+ в концентрации ан+=1 г-ион/л. На поверхности платины собирается Н2, давление которого равно 1 ата. На электроде идет реакция окисления-восстановления:
Ѕ Н2 Н+ + е.
Одна из конструкций водородного электрода выглядит так: Электродный потенциал такого электрода зависит от концентрации ионов водорода в растворе и от давления водорода в газовой фазе. При постоянном давлении РН2=1 ата, и аН+=1, принято Е0Н+=0 при аН+1, Ен+=Е0+RT/Flnан+.
Электродным потенциалом (F) данного электрода называется величина, равная его потенциалу по отношению к нормальному водородному электроду.
,


где Еэабс — абсолютное значение потенциала электрода; - абсолютное значение водородного электрода; Ек и Ед — контактный потенциал и диффузный потенциал.
Лекция № 5
При записи цепей, служащих для определения электродного потенциала (Е), принято водородный электрод указывать слева. Определим электродный потенциал меди. Для этого составляется гальваническая цепь из двух электродов: нормального водородного и медного.
Pt, H2H+Cu2+Cu
АН+=1, аCu2+=а+
Реакция, которая протекает при работе гальванического элемента, отвечает уравнению:
Сu2++Н2Сu+2Н+
При этом на аноде (норм. вод. электрод): Н22Н++2е На катоде (медный электрод): Cu2++2eCu
Электродный потенциал медного электрода численно равен ЭДС такого гальванического элемента. Знак электродного потенциала в общем случае зависит от соотношения концентраций (активностей) ионов в растворе. Электродный потенциал положителен, если активности ионов таковы, что реакция протекает в прямом направлении (слево-направо) и Z0. Если в противоположном направлении — то электродный потенциал отрицателен.
Реакция (1) при обычных концентрациях ионов меди в растворе протекает в прямом направлении. Поэтому электродный потенциал меди в обычных условиях положителен.
Пользуясь уравнением для ЭДС элемента и учитывая, что в нормальном водородном электроде РН2=1; аН+=1, и активность меди аcu=1, получим для реакции (1), протекающей на элементе (Cu — Н2):

.
Зависимость Е электрода от активной концентрации соответствующего катиона в растворе:

,
где Ео — нормальный электродный потенциал меди, т. е. при аCu2+=1
Это уравнение называется уравнением Нернста.
Е0=const для данного металла при Т — const. (В общем случае, нормальным (стандартным) потенциалом данного электрода называется потенциал его, когда активность ионов, которыми определяется электродный процесс, равна единице). Нормальные электродные потенциалы разных электродов принято располагать по водородной шкале. Например:
Е0, В. | — 3,04. | — 2,7. | — 0,763. | — 0,44. | 0,337. | 0,401. | 2,87. | ||
Электрод. | Li+/Li. | Na+/Na. | Zn2+/Zn. | Fe2+Fe. | H+H. | Cu2+Cu. | ОН-О2(Р t). | F- F2(P t). | |
Нормальный потенциал, расположенный правее в электрохимическом ряду (Cu2+Cu) будет протекать восстановление (катод), а на электроде, расположенном левее (Zn2+/Zn) — окисление (анод).
Зная стандартные (нормальные) электродные потенциалы Е0, нетрудно, пользуясь уравнением (2) рассчитать и электродные потенциалы данного металла в растворах любых концентраций, если концентрация (активность) электролита известна. Пользуясь уравнением (2) можно рассчитать и ЭДС элемента, как разность электродных потенциалов:

,
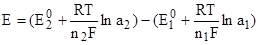
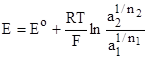

где — нормальная ЭДС элемента, или ЭДС в стандартных условиях: а2=а1=1.
Примечание: в уравнении (3) при расчете ЭДС элемента Е=Е2-Е1 не учтен диффузионный потенциал, что ведет к некоторому отличию расчетных значений Е от определенных экспериментальным путем.
Пример: рассчитать нормальную ЭДС элемента Даниэля:
(-) CuZnZnSO4CuSO4Cu (+)

.
Экспериментальное определение дает значение Е=1,087 В.
Электроды сравнения и измерения Основным электродом сравнения, как мы говорили, является водородный электрод. Однако этот электрод очень чувствителен к изменению условий среды, что сильно усложняет работу с ним. Поэтому на практике для определения потенциала некоторого электрода, этот электрод соединяют в электро химический элемент не с водородным, а с другим электродом сравнения, потенциал которого точно известен по отношению к водородному электроду. В качестве таких электродов сравнения обычно используют каломельный или хлорсеребряный электрод.
Эти электроды относятся к электродам второго рода. Вообще, принято различать электроды первого и второго рода. Электроды обратимые относительно катиона — электроды первого рода, обратимые относительно аниона — второго рода, в ряду это электроды ОН-/О2 и F-/F2. Электроды первого рода обычно металлы, погруженные в раствор соли этого металла, электроды второго рода состоят из металла, покрытого слоем малорастворимой соли и помещенные в раствор, содержащий общий с солью анион.
Каломельный электрод
Электрод второго рода, в котором паста из ртути и каломели (Hg2Cl2) помещена в раствор КСl. Схематически каломельный электрод можно записать так:
СlHg2Cl2Hg.
На электроде протекает реакция.
½ Hg2Cl2+1е Hg+Cl-
Потенциал такого электрода определяется уравнением:
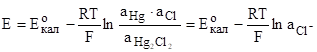
.
т.к. n=1; аHg=1; аHg2Cl2=1 или при 25оС Е=0,2678−0,058.
Таким образом, каломельный электрод является электродом, обратимым по ионам хлора, в котором ионы хлора поступают от твердого хлорида ртути. Обычно применяют каломельные электроды с содержанием 0,1 н КСl или 1,0 н. Их потенциалы при 25оС соответственно равны 0,3337; 0,2801 В. электролит адсорбация раствор Хлорсеребряный электрод Электрод 2-го рода, можно записать схемой:
СlAgCl, Ag.
Т.е. представляет собой пластину, покрытую солью AgCl и помещенную в раствор КСl. На электроде протекает реакция:
AgCl+eAg+Cl-
Его электродный потенциал при 25оС равен:
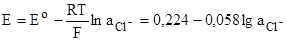
Измерительные электроды. Окислительно-восстановительные электроды и системы.
Окислительно-восстановительными называются такие электроды (или цепи), в которых материал электродов не изменяется, а лишь служит источником или приемником электронов, получаемых или отдаваемых веществами, восстанавливающими или окисляющимися на поверхности электродов. Окислительно-восстановительный электрод состоит из инертного металла, погруженного в раствор, содержащий окисленную и восстановленную форму вещества. В простой окислительно-восстановительной системе электродная реакция состоит в изменении заряда ионов по схеме:
Аок, АвосPt при протекании реакции Аок+neАвос
Электродный потенциал определяется выражением:
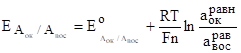
.
Примером такого электрода может служить пластина из платины, опущенная в раствор, содержащий хлористое железо и хлорное железо, т. е. FeCl2 и FeCl3, т. е. FeCl2 и FeCl3. Схема электрода:
Fe3+, Fe2+Pt.
Электродная реакция Fe2+Fe3++e (Fe3++eFe2+).
Электродная реакция пойдет вправо или влево в зависимости от того с каким другим электродом данный электрод составляет гальванический элемент. Электродный потенциал равен:
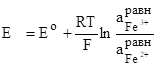
.
где Е0 — нормальный окислительно-восстановительный потенциал при аFe3+=aFe2+=1 г-ион/дм3.
Значения нормальных окислительно-восстановительных потенциалов также представляются в виде таблиц, при этом значение их определяется также по отношению к водородному электроду.
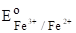
(Fe3++eFe2+)=0,771 B;
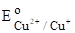
(Cu2++eCu+)=0,153 B;
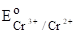
(Cr3++eCr2+)=-0,41 B.
Примером сложной окислительно-восстановительной системы может служить система ионов МnO4- и Mn2+. Схема такого элемента имеет вид: MnO4-, Mn2+, H+Pt.
Электродная реакция.
MnO4-+8H++5eMn2++4H2O.
а потенциал электрода определяется выражением:

.
Потенциометрическое определение рН и потенциометрическое титрование Определение каких-либо свойств электролита или электродов путем измерения ЭДС гальванических цепей называют потенциометрическими определениями. Из потенциометрических определений наиболее распространенными являются определение рН и потенциометрическое титрование.
Определение рН растворов потенциометрическим методом может осуществляться тремя методами (по виду применяемого электрода): водородным, хингидродным или с помощью стеклянного электрода.
Для определения рН с помощью водородного электрода составляют цепь, состоящую из водородного и каломельного электрода.
Схема цепи: (-) Н2, PtH+, A-KClHg2Cl2, Hg (+).
ЭДС такой цепи равно.
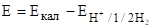
Подставляя значение Екал и и выражая рН, определяют рН раствора. рН=1/ао(Е-Екал), где ао=RT23/F.
Определение рН с помощью стеклянного электрода.
Стеклянный электрод представляет собой сосуд из тонкого стекла с повышенной электропроводностью, наполненный раствором, в который погружен электрод 1-го или 2-го рода. Принцип работы стеклянного электрода основан на том, что на границе раздела стекло-раствор возникает разность потенциалов, зависящая от рН, т.к. внутри стеклянного электрода концентрация ионов Н+ иная, чем снаружи. Электродная реакция на стеклянном электроде представляет собой обмен ионами водорода между раствором и стеклом: Н+р-рН+стекла. Такой переход иона водорода из раствора в стекло соответствует перемещению единичного заряда и потенциал электрода определяется выражением:

.
Для определения рН раствора составляют эл хим. элемент из стеклянного и вспомогательного электрода. Например, хлор-серебрянного:
(-) Ag, AgClKClиспытуемый р-р, Н+стеклянный электрод (+).
ЭДС такого элемента равна:
Е=Естекл-Ех.с.=(Есто-Ех.с.о)-ао(рН-lgаCl-), где ао=RT23/F.
Подставляя соответствующие значения, аналогично предыдущему, выражают рН.
Потенциометрическое титрование.
Заключается в измерении потенциала электрода, погруженного в титруемый раствор. Этот потенциал изменяется по мере титрования, а в точке эквивалентности имеет место скачок потенциала. Кривую титрования строят в координатах рН-Vтитранта или Е-Vтитранта. При титровании сильной кислоты сильным основанием кривая титрования выглядит так:
Величина скачка титрования зависит от концентрации исходной кислоты (как рассматривалось в объемном методе анализа).