Основные закономерности протекания химических процессов
Где n — стехиометрические коэффициенты в уравнении реакции,. При повышении температуры константа равновесия уменьшается. Где n — стехиометрические коэффициенты в уравнении реакции; Вычисляем значения константы равновесия для температур. Так как < 0, то уменьшается неупорядоченность системы. Термохимическое уравнение реакции будет иметь вид: Реакция будет находиться в равновесии, когда… Читать ещё >
Основные закономерности протекания химических процессов (реферат, курсовая, диплом, контрольная)
Задание
Дано уравнение реакции: 2NO2(г)+Br2(г)=2NOBr(г).
- 1. Для всех веществ, участвующих в реакции, выпишите из приложения 1 значения стандартных термодинамических величин и .
- 2. Вычислите изменение энтальпии реакции и определите, является ли данная реакция экзоили эндотермической. Запишите термохимическое уравнение реакции.
- 3. По виду уравнения реакции, не прибегая к расчетам, определите знак изменения энтропии реакции. Вычислив изменение энтропии реакции в стандартных условиях, объясните знак .
- 4. Вычислите энергию Гиббса прямой реакции в стандартных условиях и установите возможность самопроизвольного протекания реакции.
- 5. Определите температуру, при которой реакция находится в равновесии (Тр).
- 6. Рассчитайте при Т1 = Тр-100, Т2 = Тр+100.
- 7. Постройте график зависимости от Т и обозначьте на графике область температур самопроизвольного протекания реакции.
- 8. Вычислите значения константы равновесия Kc при температурах Тр, Т1 и Т2. Cделайте вывод о влиянии температуры на величину Kc и на смещение химического равновесия.
энтальпия энергия химический температура.
Расчеты, объяснения и выводы
1. Записываем стандартные энтальпии образования и стандартные энтропии для реагентов и продуктов реакции, используя справочные данные:
аА | вВ | сС | ||
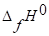 . | 90,25. | 30,92. | 79,5. | |
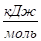  210,62. | 245,35. | 259,3. | ||
2. Вычисляем изменение энтальпии при протекании прямой реакции в стандартных условиях, используя следствие 2 закона Гесса: тепловой эффект химической реакции равен разности сумм энтальпий образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов:
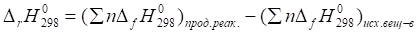
.
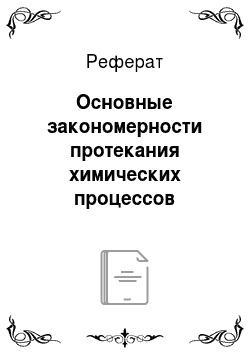
где n — стехиометрические коэффициенты в уравнении реакции,.
— стандартные энтальпии образования веществ.
=2•(NOBr)-(2•(NO2)+(Br2)).
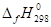
= (2•79,5) — (2•90,25+30,92) = -52,42.
Термохимическое уравнение реакции будет иметь вид:
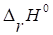
2NO2(г) + Br2(г)=2NOBr(г) ; = -52,42 кДж Так как < 0, то реакция является экзотермической.
3. По виду уравнения реакции, не прибегая к расчетам, можно объяснить знак изменения энтропии реакции следующим образом: сумма количества веществ продуктов реакции (2 моль газа) меньше, чем исходных веществ (3 моль газа). Это говорит об уменьшении неупорядоченности системы и уменьшении энтропии. Соответственно < 0.
Вычисляем изменение энтропии реакции в стандартных условиях, используя следствие из закона Гесса, по формуле.
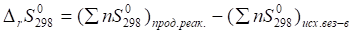
.
где n — стехиометрические коэффициенты в уравнении реакции;
— стандартные энтропии образования веществ.
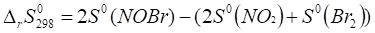
= (2•259,3) — (2•210,62 + 245,35) = -147,99.
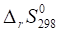
Так как < 0, то уменьшается неупорядоченность системы.
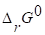
4. Вычисляем энергию Гиббса прямой реакции в стандартных условиях (298К), используя уравнение Гиббса-Гельмгольца:

.
где T=298 K;
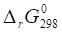
= -52,42+2980,14 799 = - 8,32.
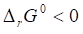
Так как, реакция протекает в прямом направлении при стандартных условиях.
5. Определяем температуру, при которой реакция будет находится в равновесии.
Реакция будет находиться в равновесии, когда .
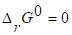
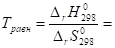
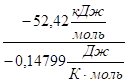
= 354,2 К.
6. Рассчитываем при .

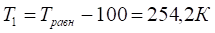
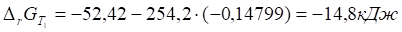
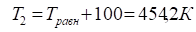
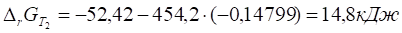
7. Строим график зависимости от и определяем область температур самопроизвольного протекания реакции.
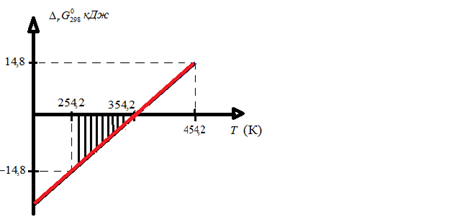
8. Вычисляем значения константы равновесия для температур .
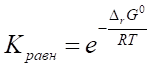
.
где R — газовая постоянная, равная 8,314.
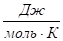


При повышении температуры константа равновесия уменьшается.
Реакция экзотермическая (< 0). Следовательно, увеличение температуры будет способствовать смещению равновесия в сторону реагентов (обратной реакции).