Сравнительный анализ чувствительности тест-систем для определения Ureaplasma urealyticum методом полимеразной цепной реакции

Применение ПЦР в диагностике заболеваний, передаваемых половым путем (ЗППП), в настоящее время получило наиболее широкое распространение. Этому способствовал ряд причин, важнейшими из которых были недостаточная эффективность применяемых ранее методов лабораторной диагностики (микроскопия, бактериальный посев, иммуноферментный анализ), быстрота выполнения ПЦР (в среднем 1 сутки), а также… Читать ещё >
Сравнительный анализ чувствительности тест-систем для определения Ureaplasma urealyticum методом полимеразной цепной реакции (реферат, курсовая, диплом, контрольная)
Сравнительный анализ чувствительности тест-систем для определения Ureaplasma urealyticum методом ПЦР.
Правильное и своевременное лечение заболеваний, вызываемых различными инфекционными агентами, требует установления точного диагноза. Для решения этой проблемы все чаще применяются современные методы молекулярной биологии. Так, к настоящему времени метод амплификации нуклеиновых кислот полимеразной цепной реакцией (ПЦР) уже достаточно широко используется в практической медицине как эффективный инструмент лабораторной диагностики [1, 2].
Применение ПЦР в диагностике заболеваний, передаваемых половым путем (ЗППП), в настоящее время получило наиболее широкое распространение. Этому способствовал ряд причин, важнейшими из которых были недостаточная эффективность применяемых ранее методов лабораторной диагностики (микроскопия, бактериальный посев, иммуноферментный анализ), быстрота выполнения ПЦР (в среднем 1 сутки), а также, до некоторой степени, относительная простота манипуляций с клиническим материалом. Первая зачастую объясняется особенностями биологии патогенных микроорганизмов, таких как мелкие размеры и невозможность (или затруднительность) культивирования вне организма человека [3].
Указанные особенности характерны для Ureaplasma urealyticum — возбудителя одного из наиболее распространенных ЗППП [4]. В настоящее время по распространенности уреаплазмоз «соперничает» с хламидийной инфекцией. И хотя уреаплазмы высеваются бактериологически, это занимает от 3 до 5 суток [5, 6].
Диагностика уреаплазмозов методом ПЦР осуществляется благодаря налаженному производству сертифицированных тест-систем. Наибольшим спросом и, соответственно, распространенностью в лабораторной практике в станах СНГ пользуются тест-системы российского производства (НПФ «Литех», «АмплисенсТМ» ЦНИИЭ МЗ РФ, «Биоком», НПФ «ДНК-Технология» и др.). Не уступая по основным качественным характеристикам аналогам ведущих мировых производителей ПЦР тест-систем («Хоффман-Ла Рош», «Перкин-Элмер» и др.), продукция российских фирм выгодно отличается в ценовом отношении, что, собственно, и является решающим фактором выбора.
Наиболее существенными характеристиками тест-систем для детекции ДНК патогенных микроорганизмов являются чувствительность (способность обнаруживать наименьшие количества молекул-мишеней) и специфичность (способность реагировать только со специфическими последовательностями-мишенями) [7, 8]. К сожалению, рекламная информация фирм-изготовителей не всегда позволяет объективно оценить потребительские качества их продукции, тем более, что некоторые характеристики являются «know how» — а именно последовательности праймеров, а подчас и локализация последовательности-мишени.
Все сказанное обусловливает неизбежность и необходимость для практических лабораторий проводить систематическую исследовательскую работу по определению сравнительной эффективности поступающих на рынок тест-систем.
Целью данного исследования была сравнительная характеристика эффективности тест-систем для амплификации ДНК патогенной бактерии Ureaplasma urealyticum производства «АмплисенсТМ» ЦНИИЭ МЗ РФ (в дальнейшем — «Амплисенс») и компании «Биоком» (далее — «Биоком»).
Материалы и методы
Выделение ДНК из экспериментальных проб проводили с использованием наборов «ДНК-сорб А» и «ДНК-сорб B» («Амплисенс»), представляющих собой комплекты лизирующих и отмы-вочных растворов на основе детергентов и этилового спирта соответственно. Адсорбция ДНК осуществляется на силикагелевом сорбенте.
Реакции амплификации ДНК осуществляли с использованием стандартных тест-систем фирмы «Амплисенс» и «Биоком» в режиме, рекомендованном фирмой-производителем.
Наборы для амплификации ДНК Ureaplasma urealyticum «Амплисенс» укомплектованы для применения технологии «горячего старта», который обеспечивается разделением праймеров, нуклео-тидов и Taq-полимеразы прослойкой воска. Расчетный объем реакционной смеси 25 мкл.
Наборы «Биоком» для амплификации ДНК Ureaplasma urealyticum представляют собой лиофи-лизированные концентрированные реакционные смеси (х2), расфасованные в 0,5 мл пробирки. Растворение лиофильного содержимого осуществляется добавлением специального раствора, поставляемого в комплекте (DNA-diluent). Расчетный объем реакционной смеси 20 мкл.
В качестве субстратов амплификации и, соответственно, молекул-мишеней использовали препарат ПКО (положительный контрольный образец) для U. urealyticum («Амплисенс»), содержавший 2,1 ГЭ/мл гена-мишени, а также образцы тотальной ДНК U. urealyticum из контрольной панели 7.
Электрофорез продуктов амплификации проводили с использованием наборов ЭФ-300 («Ампли-сенс»).
Результаты и обсуждение
В настоящей работе под специфичностью понимали узнавание идентичных молекулярных мишеней, что существенно отличается от понятия видовой специфичности тест-систем, позволяющей идентифицировать видовую принадлежность микроорганизма.
Исходной посылкой запланированных экспериментов являлось предположение о наличии последовательностей-мишеней для обеих изучаемых тест-систем в препарате «Положительный контрольный образец ДНК Ureaplasma urealyticum» (ПКО), представлявшем собой, согласно аналитическому паспорту качества «Амплисенс», тотальную ДНК, выделенную из культуры уреаплазмы фенольным методом.
Целью экспериментов было выяснение степени идентичности используемых двумя фирмами-изготовителями последовательностей-мишеней.
Для этого был поставлен ряд реакций амплификации, в которых в качестве матрицы использовали препарат ПКО U. urealyticum в различных концентрациях (табл. 1).
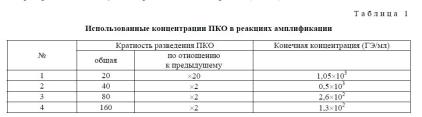
Практически пробы были приготовлены последовательными разведениями с использованием буфера для разведения ДНК («Амплисенс»): 1: 95 мкл ТЕ + 5 мкл ПКО, 2: 50 мкл ТЕ + 50 мкл № 1, 3: 50 мкл ТЕ + 50 мкл № 2,.
4: 50 мкл ТЕ + 50 мкл № 3.
Использование в качестве материала последовательных разведений имело целью определить одновременно степень чувствительности исследуемых тест-систем.
Было поставлено по 4 идентичных реакции каждой тест-системы. Условия проведения (постановка реакций, температурные режимы) соответствовали стандартам фирм-изготовителей.
Амплификацию проводили в аппарате с регулированием температур по матрице «Терцик-МС2», поэтому придерживались рекомендаций относительно температурного режима для аппаратов этого типа.
Последующий электрофорез продуктов амплификации обнаружил результаты, представленные на рисунке 1.

Анализ электрофореграммы показал отсутствие продуктов амплификации во всех пробирках с использованием тест-системы «Биоком». Неоднократное повторение эксперимента показало достоверность полученных результатов и исключило возможность влияния производственного брака, контаминации или некорректной постановки реакций. молекулярный инфекционный полимеразный амплификация Отсутствие накопления продуктов амплификации ПКО в реакциях с использованием тест-системы производства «Биоком» означает явное отличие ее специфичности от таковой у «Ампли-сенс». То есть в реакциях используются разные праймеры для амплификации последовательностей одного и того же гена либо амплифицируются последовательности разных генов, избранных в качестве характерной мишени. Сказанное носит вполне ожидаемый характер, если принять во внимание различный предсказанный размер ампликонов (756 п.н. у «Биоком» и 450 п.н. у «Амплисенс»).
Полученные результаты также позволяют сделать вывод о неполном соответствии свойств препарата ПКО U. urealyticum («Амплисенс»), заявленных в аналитическом паспорте качества. Вероятно, препарат представляет собой генно-инженерную конструкцию, содержащую искусственную последовательность-мишень, фланкированную соответствующими праймерами, как это имеет место в препарате ВКО.
Таким образом, поставленные эксперименты показали явное различие в специфичности тест-систем для детекции ДНК U. urealyticum производства «Амплисенс» и «Биоком».
Результаты, полученные в предыдущих экспериментах, не позволяли использовать для точного определения чувствительности тест-систем препараты ПКО или ВКО («Амплисенс»). Вместе с тем названные работы требуют использования растворов матриц с заранее известной концентрацией.
Оптимальным субстратом могла бы быть культура U. urealyticum с известным титром клеток. В качестве замены таковой использовали три пробы из контрольной панели для оценки качества работы лабораторий («Амплисенс») U. urealyticum. Концентрации ДНК в них были подобраны с расчетом получения определенного количества ДНК гена-мишени (табл. 2).

Представленные пробы содержали только ДНК U. urealyticum.
Однако процедура использования контрольной панели предусматривает предварительное выделение ДНК из проб по стандартной методике «Амплисенс», что подразумевает неизбежные потери.
С целью определения порядка потерь ДНК в ходе процесса выделения молекул нуклеиновых кислот были проведены контрольные эксперименты.
Предварительно приготовленные разведения препарата ПКО (концентрации — аналогично табл. 1.) использовали в качестве исходного материала для выделения ДНК с помощью набора «ДНК-сорб А» («Амплисенс»). Полученные в результате образцы использовали для постановки серии реакций амплификации с помощью тест-системы U. urealyticum «Амплисенс». Параллельно ставили серию реакций с исходными растворами ПКО, не подвергшимися процедуре выделения.
Сравнительный анализ последующего электрофореза реакционных смесей обнаружил явные различия в эффективности амплификации ДНК ПКО. Фотография электрофореграммы амплифицированных фрагментов исходных ДНК и молекул, подвергшихся обработке комплектом реагентов «ДНК-сорб А», представлена на рисунке 2.
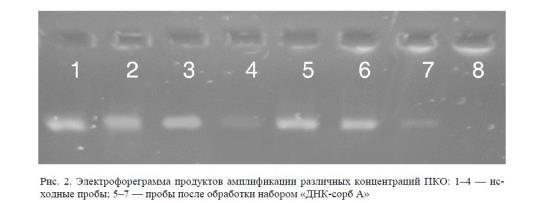
Визуальный анализ данной электрофореграммы позволяет оценить степень потерь ДНК при обработке набором «ДНК-сорб А», по меньшей мере, как двукратную.
С учетом полученных данных концентрации ДНК U. urealyticum контрольной панели (табл. 2) следует рассматривать следующим образом (табл. 3).

Обнаруженную закономерность полезно учитывать при интерпретации результатов анализов клинических проб в повседневной практике клинико-диагностических лабораторий, осуществляющих ПЦР-анализ.
Собственно эксперимент по определению чувствительности тест-систем «Амплисенс» и «Био-ком» был осуществлен постановкой параллельных рядов реакций амплификации ДНК проб контрольной панели U. urealyticum. Результаты эксперимента представлены в таблице 4 и на рисунке 3. Картину электрофореза, представленную на рисунке, обрабатывали компьютерной системой Totallab.
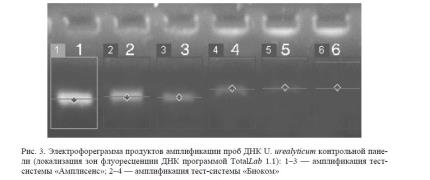

Полученные данные свидетельствуют о том, что чувствительность тест-системы «Биоком», как минимум, в два раза ниже, чем таковая тест-системы «Амплисенс».
Данные денситометрического анализа фотоснимка коррелируют с визуальными, приведенными в таблице 4.
Таким образом, получены экспериментальные данные, доказывающие, как минимум, двукратное превышение порога чувствительности тест-системы «Амплисенс» по сравнению с тест-системой «Биоком».
- 1. Херрингтон С., Макги Дж. Молекулярная клиническая диагностика. — М.: Мир, 1999.
- 2. Colaizy T.T., Kuforiji T., Sklar R.S., Pillers D.A. PCR methods in clinical investigations of human ureaplasmas: a minireview. Mol. Genet. Metab. — 2003 Dec;80(4):389−97.
- 3. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. — М.: Мир, 2002. — 589 с.
- 4. Агапов С. А. ПЦР в диагностике уреаплазм и микоплазм // Ureaplasma.info. — 2009. — 11 авг.
- 5. Rastawicki W., Kalota H., Jagielski M. et al. Comparison of polymerase chain reaction assay and Mycoplasma IST 2 test with culture for detection of infections caused by Ureaplasma urealyticum and Mycoplasma hominis // Med. Dosw. Mikrobiol. (Poland). — 2004. 56(1). — Р. 99−108.
- 6. Погосян Г. П., Ли К. Г., Жуманбаева Г. К., Подоляк С. С., Шалтаева Н. А. Применение ПЦР в диагностике инфекций, передающихся половым путем, в Карагандинской области. Генодиагностика инфекционных заболеваний: Сб. тезисов 4-й Всерос. науч.-практ. конф. — М., 2002. — С. 62.
- 7. Pitcher D., Sillis M., Robertson J.A. Simple method for determining biovar and serovar types of Ureaplasma urealyticum clinical isolates using PCR-single-strand conformation polymorphism analysis // J.Clin. Microbiol (United States). — 2001. — — 39 (5). — Р. 1840−1844.
- 8. Kong F., Zhu X., Wang W et al. Comparative analysis and serovar-specific identification of multiple-banded genes of Ureaplas-ma urealyticum biovar 1 // J.Clin. Microbiol. — 1999. —; 37(3):538−543.