Лекция №3. Газовые законы.
Основные газовые процессы
Для описания состояния идеального газа пользуются уравнением Менделеева-Клапейрона: Уравнением, объединяющим газовые законы Бойля-Мариотта и Гей-Люссака, является: Например, мольная масса атмосферного воздуха при н.у. составляет около 29 г/моль. Например, плотность атмосферного воздуха при н.у. составляет 1,29 кг/м3. Плотность функционально зависит от температуры Т и давления Р: Плотность смеси… Читать ещё >
Лекция №3. Газовые законы. Основные газовые процессы (реферат, курсовая, диплом, контрольная)
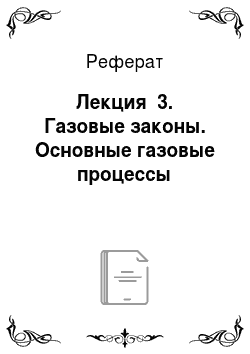
Под парциальным давлением газа Рп понимают давление этого газа в предположении, что при температуре смеси в объёме, занимаемом смесью, находится только рассматриваемый газ. В соответствии с законом Дальтона, давление смеси идеальных газов равно сумме парциальных давлений этих газов: Р=.
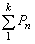
Для описания состояния идеального газа пользуются уравнением Менделеева-Клапейрона:
РV=, где: P — давление газа, Па; V — объём газа, м3; T — температура газа, К; m — масса газа, кг; M — мольная масса газа, кг/моль; R=8,31 Дж/(моль*К) — универсальная газовая постоянная.
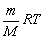
Уравнением, объединяющим газовые законы Бойля-Мариотта и Гей-Люссака, является:
где: индекс «0» означает начальное состояние системы, например, при нормальных условиях; индекс «1» означает некоторое конечное состояние системы. Нормальными условиями (н.у.) считают Р0 =101,3кПа (нормальное атмосферное давление) и Т0=298К (25С). Однако во многих случаях приходится использовать в качестве нормальной температуры не 298К, а 273К (0С). Это обусловлено тем, что многие справочные данные, необходимые для расчётов, получены не при 298К, а именно при 273К.

Плотность любого газа можно определить как:
кг/м3. Где: Мг — мольная масса газа; Vст=22,4 л/моль — объём, занимаемый 1 молем любого газа при н.у. (стандартный объём).
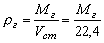
Плотность смеси газов определяется следующим образом:
кг/м3. Где: i — плотность итого газового компонента смеси, кг/м3; i — объёмное содержание итого газового компонента смеси, %; n — количество газовых компонентов смеси.
Например, плотность атмосферного воздуха при н.у. составляет 1,29 кг/м3.
Плотность функционально зависит от температуры Т и давления Р:
Выведем функциональную зависимость плотности от температуры и давления. Для этого запишем объединённое уравнение в форме:
.

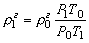
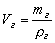
Аналогично плотности смеси газов рассчитывается мольная масса смеси газов:, г/моль. Где: Мi — мольная масса итого газового компонента смеси, г/моль; i — объёмное содержание итого газового компонента смеси, %; n — количество газовых компонентов смеси.

Например, мольная масса атмосферного воздуха при н.у. составляет около 29 г/моль.
Основные газовые процессы
Процессы, в которых участвует система, могут протекать при различных условиях. В связи с этим различают следующие основные варианты реализации указанных процессов.
- 1. Изохорный процесс. Объём системы остаётся постоянным (dV=0). Поэтому элементарная работа расширения системы Ар=PdV=0, а вся теплота, сообщенная системе расходуется на изменение внутренней энергии, т. е. теплота приобретает свойства функции системы (не зависит от пути процесса): Qv=dU или Qv=U2-U1.
- 2. Изобарный процесс. Давление Р=соnst. Таким образом dQp=d (U+PV), а работа расширения равна: Ар=Р (V2-V1).
- 3. Изотермический процесс. Т=const. QT=Ap=PdV Ap=RT*ln (V2/V1)=
=RT*ln (P1/P2).
4. Адиабатический процесс. Q=0. При адиабатическом процессе работа совершается системой за счёт убыли её внутренней энергии.
Более детально все эти процессы будут рассмотрены далее, в лекциях, посвящённых термодинамике. Здесь эти процессы указаны только для получения общих представлений. Следует также отметить, что наиболее общим случаем всех газовых процессов является политропный процесс (соотношение параметров выражено через величину n — показатель политропы).