Гетерофункциональные природные соединения

Наибольшее биологическое значение имеют б-аминокислоты. Они являются структурными компонентами полипептидов и белков, многие из них служат биологическими предшественниками биогенных аминов — гормонов и биорегуляторов. Реакция обратима — оксокислоты могут восстанавливаться (гидрироваться) в оксикислоты. Эти процессы имеют особо важное значение в биохимических превращениях, например, «молочная… Читать ещё >
Гетерофункциональные природные соединения (реферат, курсовая, диплом, контрольная)
Большинство природных соединений являются гетерофункциональными, т. е. содержат различные функциональные группы. Наиболее часто встречающиеся и наиболее важные из них: СООН, ОН, С=О, NH2.
Оксикислоты. Содержат карбоксильные и гидроксильные группы:
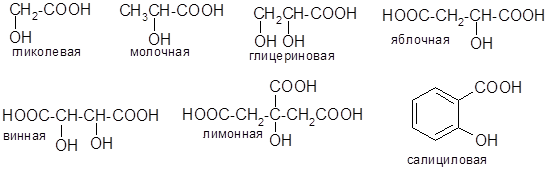
Способы получения.
- 1. Гидролиз галогенпроизводных кислот (для всех кроме в-оксикислот):
- 2. Гидратация б, в-непредельных кислот (для в-оксикислот):
- 3. Циангидринный способ (для б-оксикислот):
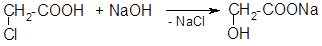
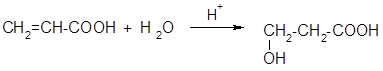
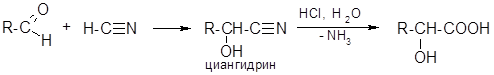
Химические свойства. Оксикислоты объединяют в себе свойства карбоновых кислот и спиртов (см.)
1) Кислотность Кислотность СООН-группы увеличивается за счет электроноакцепторного влияния ОН-группы, особенно сильно у б-оксикислот:
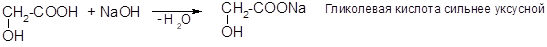
Особые свойства оксикислот связаны с взаимодействием СООНи ОН-групп.
2) Образование лактидов (б-оксикислоты):
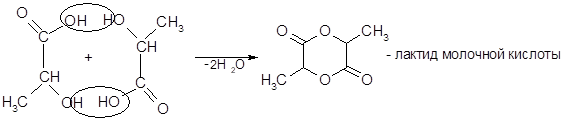
- 3) Дегидратация (в-оксикислоты):
- 4) Образование лактонов (ги д-оксикислоты):
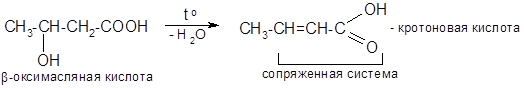
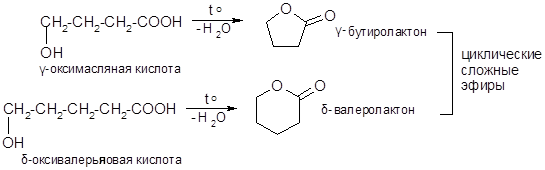
Отдельные представители оксикислот. Молочная кислота. Впервые выделена К Шееле из кислого молока (1780 г.). Широко распространена как продукт биохимического брожения (гликолиз), является одним из ключевых метаболитов в обмене углеводов.
Лимонная кислота. Содержится в лимонах (6−8% сухой массы), в листьях махорки (откуда раньше получалась промышленным способом). Сейчас основной способ её получения — биохимическое лимоннокислое брожение под действием определенного штамма грибов. В организме является одним из ключевых метаболитов энергетического обмена в цикле трикарбоновых кислот (цикл Кребса).
Салициловая кислота. Выделена из коры ивы (Salix). Обладает антисептическими свойствами и применяется в медицине, а также как консервант пищевых продуктов. В медицине и фармации в качестве лекарственных средств широко применяются производные салициловой кислоты по обеим функциональным группам:
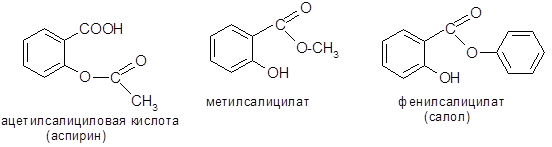
Оксокислоты.
Содержат СООН и С=Огруппы:

Способы получения В основном способы получения оксокислот сводятся к образованию СООН и С=О-групп (см. способы подучния карбоновых кислот, альдегидов и кетонов).
1) Гидролиз б-оксонитрилов:

2) Окисление (дегидрирование) оксикислот:
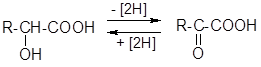
Реакция обратима — оксокислоты могут восстанавливаться (гидрироваться) в оксикислоты. Эти процессы имеют особо важное значение в биохимических превращениях, например, «молочная кислота — пировиноградная кислота» .
Химические свойства. Оксокислоты образуют производные по карбоксильной и по карбонильной группам (см. химические свойства карбоновых кислот, альдегидов и кетонов).
1) Кислотность.

Карбонильная группа более сильный ЭА, чем гидроксильная, поэтому кислотность у оксокислот выше, чем у соответствующих оксикислот.
2) Декарбоксилирование Элетроноакцепторное действие С=О-группы способствует элиминированию карбоксильной группы; би в-оксокислоты легко декарбоксилируются:

Кето-енольная таутомерия в-оксокислот Таутомерия — это способность химического соединения существовать в виде равновесной смеси изомеров (равновесная изомерия).
Такое равновесие возможно и в простых альдегидах и кетонах, но там содержание енольной формы ничтожно мало. Совместное ЭА влияние СООНи С=О-групп в в-кетокислотах 1) значительно увеличивает подвижность протонов у б-углерод-ного атома и 2) образующаяся енольная форма содержит сопряженную систему, что значительно увеличивает её термодинамическую устойчивость.
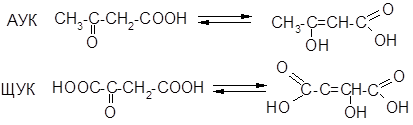
По этим причинам в-кетокислоты существуют в виде равновесия «кетон — енол», где содержание енольной формы достигает многих процентов.
АЦЕТОУКСУСНЫЙ ЭФИР.
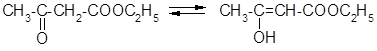
Равновесие содержит около 8% енольной формы и её можно обнаружить с помощью цветной реакции с FeCl3.
Применение в органическом синтезе.

Аминокислоты.
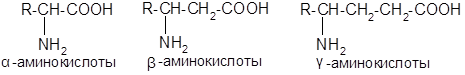
Наибольшее значение имеют б-аминокислоты, т.к. они являются метаболитами в обмене веществ и «строительным материалом» для важнейших биополимеров — полипептидов и белков.
Стереоизомерия а-аминокислот.

Все аминокислоты, участвующие в обмене веществ и входящие в состав полипептидов и белков, имеют L-конфигурацию (стереоспецифичность ферментов).
Способы получения аминокислот.
1) Из галогенопроизводных кислот:
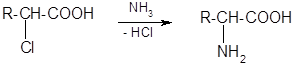
2) Из альдегидов (метод Штреккера-Зелинского):
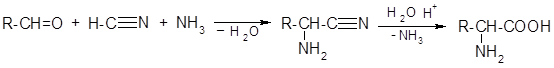
3) Из нитроуксусной кислоты:
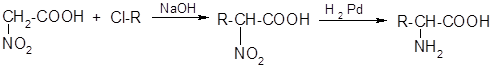
4) Восстановительное аминирование б-оксокислот:
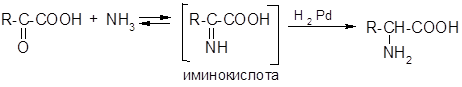
Химические свойства.
- 1) Кислотно-основные свойства
- а) амфотерность:
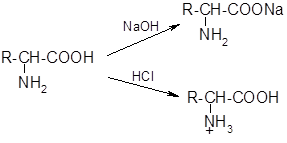
б) образование биполярных ионов (цвиттер-ионов):
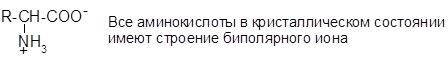
в) строение аминокислот в растворе:
Ионогенная группа — это функциональная группа, которая в водном растворе имеет структуру иона.
Аминокислоты содержат две ионогенные группы:
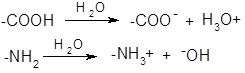
В водном растворе молекулы аминокислот всегда имеют электрический заряд, изменяющийся при изменении рН раствора.
Изоэлектрическая точка (рI) — это значение рН, при котором суммарный заряд молекулы равен О.
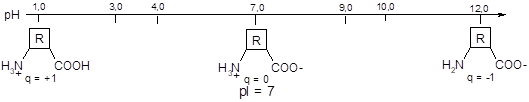

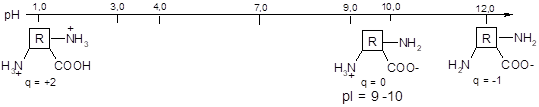
- 1) Если количества ионогенных групп (COOH и NH2) в молекуле одинаковы, то изолектрическая точка АК находится в области нейтрального рН (pI = 7, нейтральные АК).
- 2) Если в молекуле преобладают карбоксильные группы, то изолектрическая точка АК находится в кислотной области рН (pI < 7, кислые АК).
- 3) Если в молекуле преобладают аминогруппы, то изолектрическая точка АК находится в основной области рН (pI > 7, основные АК).
- 4) Если рН раствора ниже ИЭТ, то молекула имеет положительный заряд, если рН раствора выше ИЭТ, то молекула имеет отрицательный заряд.
Эти закономерности справедливы не только для индивидуальных аминокислот, но и для их полимеров — полипептидов и белков.
2) Реакции карбоксильной группы Общие реакции: образование солей и функциональных производных.
Декарбоксилирование:

3) Реакции аминогруппы Общие реакции: образование солей, ацилирование, алкилирование.
Дезаминирование:
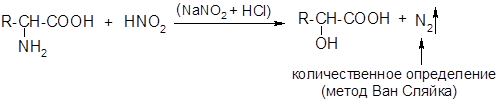
Наибольшее биологическое значение имеют б-аминокислоты. Они являются структурными компонентами полипептидов и белков, многие из них служат биологическими предшественниками биогенных аминов — гормонов и биорегуляторов.
оксикислота оксокислота аминокислота.
Многие аминокислоты применяются как лекарственные препараты:

Некоторые аминокислоты (например, глицин) имеют сладкий вкус. Особенно интенсивный сладкий вкус имеет дипептид Асп-Фен. Под названием аспартам он применяется как заменитель сахара для диабетиков:
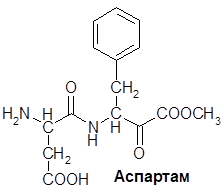
Основная.
- 1. Белобородов В. Л., Зурабян С. Э., Лузин А. П., Тюкавкина Н. А. — Органическая химия (основной курс), кн. 1 — Дрофа, М., 2003 г., с. 558−604.
- 1. Тюкавкина Н. А., Зурабян С. Э., Белобородов В. Л. и др. — Органическая химия (специальный курс), кн.2 — Дрофа, М., 2008 г., с. 178−207.
Дополнительная.
2. Н. А. Тюкавкина, Ю. И. Бауков — Биоорганическая химия — ДРОФА, М., 2007 г., с. 316−345.