Электролитическая диссоциация.
Реакции ионного обмена

Растворение в воде других веществ (кислот, оснований, солей) изменяет концентрацию ионов Н+ или ОН-, а их произведение всегда остается постоянным и равным 10−14 при Т=250С. Концентрация ионов Н+ может служить мерой кислотности или щелочности раствора. Обычно для этой цели используется водородный показатель: pH = -lg. Таким образом, водородный показатель — это десятичный логарифм концентрации… Читать ещё >
Электролитическая диссоциация. Реакции ионного обмена (реферат, курсовая, диплом, контрольная)
Электролитическая диссоциация — это процесс распада молекул электролита на ионы под действием полярных молекул растворителя.
Электролиты — это вещества, расплавы или водные растворы которых проводят электрический ток. К ним относятся растворы кислот, расплавы и растворы щелочей и солей. Неэлектролиты — это вещества, которые не проводят электрический ток. К ним относятся многие органические вещества.
Электролиты, которые практически полностью диссоциируют на ионы, называются сильными; электролиты, которые частично диссоциируют на ионы, называются слабыми. Для количественной оценки полноты диссоциации введено понятие степени диссоциации. Степенью диссоциации электролита называют отношение числа молекул, распавшихся на ионы, к общему числу молекул, находящихся в растворе.
Обычно степень диссоциации (б) выражают в долях единицы или %:

(12).
где n — число частиц, подвергшихся электролитической диссоциации;
n0 — общее число частиц в растворе.
Сильные электролиты — почти все соли, растворимые основания (NaOH, KOH, Ba (OH)2 и др.), неорганические кислоты (H2SO4, HCl, HNO3, HBr, HI и др).
Слабые электролиты — нерастворимые основания и NH4OH, неорганические кислоты (H2CO3, H2S, HNO2, H3PO4 и др.), органические кислоты и вода H2O.
Сильные электролиты диссоциируют на ионы практически нацело (т.е. процесс диссоциации является необратимым) и одностадийно:
HCl = H+ + ClH2SO4 = 2H+ + SO42;
Слабые электролиты диссоциируют частично (т.е. процесс диссоциации является обратимым) и ступенчато. Например, для многоосновных кислот на каждой стадии происходит отрыв одного иона водорода:
1. H2SO3? H+ + HSO3- 2. HSO3-? H+ + SO32;
Таким образом, число стадий многоосновных кислот определяется основностью кислоты (числом ионов водорода), а число стадий многокислотных оснований будет определяться кислотностью основания (или числом гидроксильных групп): NH4OH? NH4+ + OH-. Процесс электролитической диссоциации завершается установлением в системе состояния химического равновесия, которое характеризуется константой равновесия:
Константа равновесия процесса электролитической диссоциации называется константой диссоциации — КД. Константа диссоциации зависит от природы электролита, природы растворителя, температуры, но не зависит от концентрации электролита.
Между КД и б существует количественная связь:

(13).
Соотношение (13) называют законом разбавления Оствальда: степень диссоциации слабого электролита возрастает с разбавлением раствора.
Для слабых электролитов, когда б1, КД = б2С.
Вода является слабым электролитом, поэтому диссоциирует обратимо:
H2O? H+ + OH- ?H = +56,5кДж/моль Константа диссоциации воды:
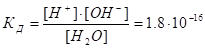
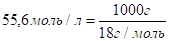
Степень диссоциации воды очень мала (это очень слабый электролит). Так как вода присутствует в большом избытке, то ее концентрация может считаться величиной постоянной и составляет, тогда КД [H2O] = [H+]•[OH-] = 55,6•1,8•10−16 = 10−14.
[H+]•[OH-] = 10−14 = KW — ионное произведение воды.

Так как в воде концентрации катионов водорода и гидроксид-ионов равны, то: [H+] = [OH-] = .
Растворение в воде других веществ (кислот, оснований, солей) изменяет концентрацию ионов Н+ или ОН-, а их произведение всегда остается постоянным и равным 10−14 при Т=250С. Концентрация ионов Н+ может служить мерой кислотности или щелочности раствора. Обычно для этой цели используется водородный показатель: pH = -lg[H+]. Таким образом, водородный показатель — это десятичный логарифм концентрации ионов водорода, взятый с обратным знаком.
В зависимости от концентрации ионов водорода различают три среды.
В нейтральной среде [H+] = [OH-]= 10−7 моль/л, рН= - lg 10−7 = 7. Эта среда характерна как для чистой воды, так и для нейтральных растворов. В кислых растворах [H+] > 10−7моль/л, рН < 7. В кислых средах рН меняется в пределах 0 < рН < 7. В щелочных средах [H+] < [ОН-] и [H+] 7. Пределы изменения рН: 7 < рН < 14.
Реакции ионного обмена (РИО) — это реакции между ионами, протекающие в водных растворах электролитов. Отличительная особенность обменных реакций: элементы, входящие в состав реагирующих веществ, не меняют свою степень окисления. Реакции ионного обмена являются необратимыми реакциями и протекают при условии: 1) образования малорастворимого вещества, 2) выделения газообразного вещества, 3) образования слабого электролита.
При протекании РИО противоположно заряженные ионы связываются и выводятся из сферы реакции. Сущность реакций ионного обмена выражают с помощью ионных уравнений, которые, в отличие от молекулярных, показывают истинных участников реакции. При составлении ионных уравнений следует руководствоваться тем, что вещества малодиссоциирующие, малорастворимые (выпадающие в осадок) и газообразные записываются в молекулярной форме. Сильные растворимые электролиты записываются в виде ионов. Поэтому при написании ионных уравнений необходимо пользоваться таблицей растворимости солей и оснований в воде.
Гидролиз — это процесс взаимодействия ионов соли с молекулами воды, приводящий к образованию малодиссоциированных соединений; является частным случаем реакций ионного обмена. Гидролизу подвергаются соли, образованные:
слабой кислотой и сильным основанием (NaCH3COO, Na2CO3, Na2S,);
слабым основанием и сильной кислотой (NH4Cl, FeCl3, AlCl3,);
слабым основанием и слабой кислотой (NH4CN, NH4CH3COO).
Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются: Na2SO4, BaCl2, NaCl, NaJ и т. д.
Гидролиз солей увеличивает концентрации ионов Н+ или ОН-. Это приводит к смещению ионного равновесия воды и в зависимости от природы соли сообщает раствору кислую или щелочную среду (см. примеры решения задач).
Примеры решения задач Пример 1. Вычислить константу диссоциации уксусной кислоты СН3СООН, зная, что в 0,1 М растворе она диссоциирована на 1,32%.
Р е ш е н и е. Для решения задачи воспользуемся законом разбавления Оствальда — уравнение (13), в котором С — концентрация уксусной кислоты, — степень ее диссоциации в данном растворе, значение которой равно 1,32/100=0,0132. Таким образом,.

Ответ: константа диссоциации уксусной кислоты составляет 1,7610−5.
Пример 2. Вычислить значение рН 0,1 М раствора гидроксида аммония NH4OH, приняв степень диссоциации раствора равной 1%.
Р е ш е н и е. 1) Записываем уравнение диссоциации раствора NH4OH:
NH4OH? NH4+ + OH;
- 2) Так как гидроксид аммония — слабый электролит и процесс его диссоциации носит обратимый характер, к моменту равновесия в 1 л раствора продиссоциировало С моль NH4OH (С = 0,1 моль/л) и образовалось столько же моль ОН- - ионов: [OH-] = С = 0,10,01 = 110−3 моль/л, следовательно, рОН = 3
- 3) Рассчитываем значение рН: pH + pOH = 14, рН = 14 — 3 = 11.
Ответ: рН 0,1 М раствора гидроксида аммония равно 11.
Пример 3. Выразить с помощью ионного уравнения сущность реакции:
Pb (NO3)2 + KI.
Р е ш е н и е. 1) Составляем молекулярное уравнение реакции:
Pb (NO3)2 + 2KI PbI2 + 2KNO3.
Отмечаем, что в результате образуется нерастворимое вещество PbI2.
2) Составляем полное ионное уравнение (все сильные электролиты записываем в виде ионов, слабые, уходящие из сферы реакции — в виде молекул):
Pb2+ + 2NO3- + 2K+ + 2I- = PbI2 + 2K+ + 2NO3;
3) Составляем сокращенное ионное уравнение, в котором исключаем все ионы, повторяющиеся в обоих частях уравнения, т. е. ионы не участвующие в реакции:
Pb2+ + 2NO3- + 2K+ + 2I- = PbI2 + 2K+ + 2NO3;
Pb2++ 2I- = PbI2.
Из сокращенного ионного уравнения видно, что сущность реакции сводится к взаимодействию ионов Pb2+ и I-, в результате которого образуется труднорастворимое вещество PbI2.
Пример 4. Определить характер среды водного раствора соли ZnCl2.
Р е ш е н и е. ZnCl2 — соль образованная сильной кислотой HCl и слабым основанием Zn (OH)2, следовательно, подвергается гидролизу по катиону. Так как катион двухзарядный, гидролиз будет протекать по двум ступеням.
I ступень:
а) записываем уравнение процесса диссоциации ZnCl2:
ZnCl2 = Zn2+ + 2Cl;
Подчеркнем ион, по которому идет гидролиз, это ион Zn2+.
б) процесс взаимодействия иона Zn2+ с водой происходит по схеме:
Zn2+ + H±OH-? (ZnOH)+ + H+.
в) запишем суммарное уравнение гидролиза:
ZnCl2 = Zn2+ + 2Cl;
Zn2+ + H2O? (ZnOH)+ + H+.
ZnCl2 + Zn2+ + H2O? Zn2+ + (ZnOH)+ + 2Cl- + H+.
После преобразований получаем:
ZnCl2 + H2O? Zn (OH)Cl + HCl.
В результате гидролиза образуется сильная кислота HCl, поэтому рН < 7.
II ступень:
При рассмотрении гидролиза по второй ступени используется аналогичный подход.
- а) Zn (OH)Cl = (ZnOH)+ + Cl-
- б) (ZnOH)+ + H±OH- = Zn (OH)2 + H+
- в) Zn (OH)Cl = (ZnOH)+ + Cl-
- (ZnOH)+ + H2O = Zn (OH)2 + H+
Zn (OH)Cl + H2O = Zn (OH)2 + HCl.
Таким образом, в результате гидролиза по второй ступени образуется сильная кислота HCl, которая создает кислую среду раствора (рН < 7).