Температурно-кинетические исследования анодного выделения хлора на металлооксидных анодах

В качестве таких значений были выбраны 1,37, 1,39 и 1,41 В (н.в.э.), входящие в диапазон потенциалов окисления хлорид-ионов и не достигающие критического потенциала. Значения плотности тока при этих потенциалах для разных температур и составов каталитического покрытия были преобразованы в координаты (рис. 2) и для полученных прямых рассчитан угловой коэффициент, который пропорционален кажущейся… Читать ещё >
Температурно-кинетические исследования анодного выделения хлора на металлооксидных анодах (реферат, курсовая, диплом, контрольная)
Аннотация
Проведена оценка зависимости анодного потенциала от температуры и плотности тока. Установлено, что энергия активации процесса анодного окисления ОРТА, ОРТА-И1 и ОИТА снижается с ростом потенциала, что соответствует лимитирующей стадии переноса заряда. Энергия активации анодного процесса относится к совокупности процессов трансформации каталитического покрытия и анодного окисления хлорид-ионов. Последний процесс лимитирует адсорбция атомарного хлора, а повышение энергии активации коррелируется с повышением коррозионной стойкости. Зависимость энергии активации от содержания в каталитическом слое иридия имеет экстремальный характер. Максимум достигается при содержании иридия 60−70%.
Ключевые слова: ОРТА, ОРТА-И1, ОИТА, энергия активации, анодное окисление, адсорбция хлора, гипохлорит натрия, хлор, перенос заряда, смешанный оксид, электродный потенциал.
В настоящее время наибольшее распространения получило обеззараживание воды различными хлорсодержащими окислителями — дезинфектантами (газообразный хлор, хлорамины, диоксид хлора и др.). Однако дороговизна, высокая токсичность и сложность получения сдерживают широкое применение их в обеззараживании воды [1−3]. Наиболее приемлемыми являются сжиженный хлор и водные растворы гипохлорита натрия [3, 4]. В последние годы основным анодным материалом в производстве хлорсодержащих веществ, в частности гипохлорита натрия, стали оксидно-рутениевые титановые аноды (ОРТА), обладающие хорошими поляризационными характеристиками и высокой коррозионной стойкостью [6]. ОРТА нашли применение в хлор-щелочном производстве, в производстве хлората натрия и дезинфицирующих растворов гипохлорита натрия из вод малой солености, морской воды, при очистке сточных вод [7]. Несмотря на значительный опыт их промышленного использования, знания о природе их электрокаталитических и коррозионных свойств, проявляемых в процессах электролиза хлоридных растворов, недостаточны [8, 9]. Это препятствует совершенствованию ОРТА, выявлению всех их полезных ресурсов, а также созданию новых металлоокисных анодных композиций с заранее заданными свойствами.
Ранее сообщалось [5], что в процессе анодной поляризации происходит изменение свойств каталитических покрытий за счет перехода в раствор его компонентов, в связи с этим представлялось интересным оценить энергию активации протекающих на нем процессов, для чего был использован температурно-кинетический метод. ток температура анодный потенциал.
Методика экспериментальных исследований
Питающий раствор приготовлялся из дистиллированной воды и NaCl марки «Экстра».
Исследуемые электроды представляли собой пластины из титана марки ВТ 1−0, размерами 10Ч10 мм и толщиной 1 мм с приваренными титановыми токоподводами из проволоки диаметром 2 мм. Активные покрытия, состоящие из смешанных оксидов титана, рутения и иридия, представляли собой следующие составы:
- — стандартные ОРТА с удельной закладкой рутения 6,7 г/м2;
- — ОРТА-И1 с суммарными удельными закладками иридия и рутения 6,7; 12 и 16 г/м2;
- — ОИТА содержащий IrO2 с удельной закладкой иридия 6,7 г/м2.
Гальваностатические измерения проводились в термостатированной ячейке с проточным электролитом.
Рабочий ток при измерении потенциалов задавался с помощью потенциостата П-5848, работающего в гальваностатическом режиме.
Потенциалы измерялись относительно хлорсеребряного электрода и пересчитывались по НВЭ. Каждая точка выдерживалась при постоянном значении тока в течение 10 мин. Разброс данных на различных электродах одного состава не превышает ± 0,02 В.
Целью проведенного цикла поляризационных исследований была оценка зависимости анодного потенциала от температуры и плотности тока.
Результаты и их обсуждение
Преобразование анодных поляризационных кривых в полулогарифмические координаты (рис. 1) позволило рассчитать энергию активации при нескольких значениях потенциала.
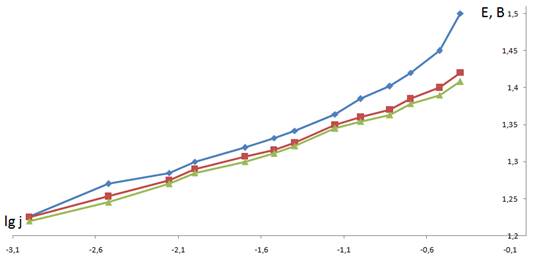
Рисунок 1 Анодные поляризационные кривые в полулогарифмических координатах: — ОРТА; - ОРТА-И1; - ОИТА.
В качестве таких значений были выбраны 1,37, 1,39 и 1,41 В (н.в.э.), входящие в диапазон потенциалов окисления хлорид-ионов и не достигающие критического потенциала. Значения плотности тока при этих потенциалах для разных температур и составов каталитического покрытия были преобразованы в координаты (рис. 2) и для полученных прямых рассчитан угловой коэффициент, который пропорционален кажущейся энергии активации (табл. 1). Как видно, энергия активации снижается с ростом потенциала, что соответствует лимитирующей стадии переноса заряда. Кроме того, при всех значениях потенциала энергия активации для ОРТА-И1 выше, чем для ОРТА (рис. 3). Из практики [10] известно, что добавка к ОРТА иридия повышает коррозионную стойкость покрытий и незначительно снижает выход активного хлора.
Учитывая, что процесс окисления хлорид-ионов на ОРТА включает три стадии: Cl- - e- = Clad; Clad — e- = (Clad??)+1; Cl- + (Clad??)+1 = Cl2, причем медленной является вторая стадия [11], наиболее существенным представляется способность покрытия к адсорбции атомарного хлора. По-видимому, оксидно-иридиевая фаза представляет энергетически более выгодный субстрат для адсорбции хлорид-ионов. Энергия активации собственно переноса заряда при этом значительно меньше влияет на выход продукта [12].
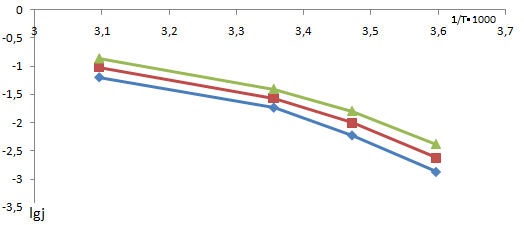
Рисунок 2 Плотность тока для разных температур в координатах lg j — (1/T)· 1000 — ОРТА; - ОРТА-И1; - ОИТА.
Таблица 1 — Кажущиеся энергии активации для процессов анодного окисления хлорид-ионов для различных потенциалов и составов каталитического покрытия.
Электрод. | Энергия активации при разных значениях потенциала, кДж/моль. | |||
1,37. | 1,39. | 1,41. | ||
ОРТА. | 26,97. | 25,765. | 24,45. | |
ОРТА-И1. | 31,63. | 30,73. | 29,8. | |
ОИТА. | 30,03. | 29,14. | ||
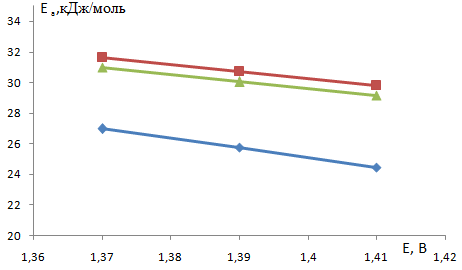
Рисунок 3 Зависимость энергии активации от потенциала — ОРТА; - ОРТА-И1; - ОИТА
Кроме того, рассчитанные значения кажущейся энергии активации относятся и к параллельно протекающим процессам трансформаций каталитического покрытия, приводящим, в конечном счете, к его растворению. В связи с этим увеличение коррозионной стойкости каталитического слоя в присутствии иридия должно коррелироваться с увеличением кажущейся энергии активации, что и наблюдается экспериментально [13]. Зависимость энергии активации от массовой доли иридия в покрытии (рис. 4) при всех значениях потенциала имеет экстремальный характер, максимум этой зависимости относится к смешанному оксиду титана-рутения иридия. Такой характер подтверждают известные [10] данные, согласно которым при закладке рутения и иридия в соотношении 80:20 наблюдается резкое увеличение коррозионной стойкости.
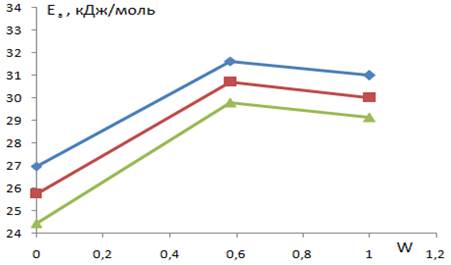
Рисунок 4 Зависимость энергии активации от массовой доли иридия (W=0 — ОРТА; W=0,6 — ОРТА-И1; W=1 — ОИТА) — 1,37В; - 1,39В; - 1,41 В.
Выводы
- 1. Энергия активации процесса анодного окисления ОРТА и ОИТА снижается с ростом потенциала, что соответствует лимитирующей стадии переноса заряда.
- 2. Энергия активации анодного процесса относится к совокупности процессов трансформации каталитического покрытия и анодного окисления хлорид-ионов. Последний процесс лимитирует адсорбция атомарного хлора, а повышение энергии активации коррелирует с повышением коррозионной стойкости.
- 3. Зависимость энергии активации от содержания в каталитическом слое иридия имеет экстремальный характер. Максимум достигается при содержании иридия 60−70%.
- 1. Измеров Н. Ф., Сноцкий И. В., Сидоров К. К. Параметры токсикометрии промышленных ядов при однократном воздействии: Справочник. М.: Медицина, 1977. 240 с.
- 2. Вредные вещества в промышленности / Под ред. Н. В. Лазарева и Э. Н. Левиной: Справочник: В 3 т. Т. 3. М.: Химия, 1976. 608 с.
- 3. Куликов А. Н., Орлов С. В., Пиманков С. И. Опыт внедрения технологии обеззараживания питьевой воды диоксидом хлора в системе централизованной хозяйственно-питьевого водоснабжения г. Нижнего Тагила// Вода и экология. 2002. № 4. С. 2−8
- 4. Кожевников А. Б., Петросян О. П. Хлорирование — микробиологическая и техническая безопасность водоподготовки: Материалы XII Международной научно-практической конференции «Проблемы управления качеством городской среды». Водная безопасность поселений России. — Москва, 2008. — 54 с.
- 5. Л. Н. Фесенко, В. И. Эбериль, М. С. Липкин, А. Ю. Скрябин, И. А. Гончаров, В. С. Спасибова, Д. Е Пушук. Особенности работы оксиднорутениево-титановых анодов в растворах хлорида натрия различных концентраций // Инженерный вестник Дона, 2016, № 4 URL: ivdon.ru/ru/magazine/archive/n2y2016/3638.
- 6. Антонов В. Н., Быстров В. И., Авксентьев В. В., Юрков JI. И., Кубасов В. Л. Окисно-рутениевые аноды на титановой основе в электролизе хлорида натрия в ваннах с диафрагмой // Химическая промышленность. — 1974. — N 8. — с. 600 — 603.
- 7. Бахир В. М. К проблеме поиска путей промышленной и экологической безопасности объектов водоподготовки и водоотведения ЖКХ// Водоснабжение и канализация. — 2009. с. 78.
- 8. Городецкий В. В., Печерский М. М., Янке В. Е., Шуб Д. М., Лосев В. В. Кинетика растворения окисных рутениево-титановых анодов при электролизе хлоридных растворов // Электрохимия. — 1979. — Т. 15, N 4. — С. 559−562.
- 9. Узбеков А. А., Клементьева В. С. Радиохимическое исследование избирательного растворения компонентов окиснорутениевых-титановых анодов (ОРТА) в хлоридных раствора // Электрохимия. — 1985. — Т. 21, N 6. — С. 758−763.
- 10. И. В. Пчельников, С. И. Игнатенко, А. А. Бабаев, Л. Н. Фесенко. Исследование коррозионных и электрохимических свойств оксидных покрытий анодов для производства низкоконцентрированного гипохлорита натрия // Инженерный вестник Дона, 2014, № 1 URL: ivdon.ru/magazine/archive/n1y2014/2242.
- 11. Вестник БГУ. Серия 2, Химия. Биология. География. — 2015. — № 2. — С. 11−14. URL: elib.bsu.by/handle/123 456 789/152093.
- 12. Denton D. A., Harrison J. A., Knowles R. I. Chlorine evolution and reduction on electrodes. Electrochim. Acta, 1979. pp. 521−527.
13. Denton D. A., Harrison J. A., Knowles R. I. Automation of electrode kinetics — IV. The chlorine evolution reaction on a plate electrode. D.A. Denton, J. A. Harrison, R. I. Knowles. Electrochim, Acta, 1980. pp. 1147−1152.
References
- 1. Izmerov N.F., Snockij I.V., Sidorov K.K. Parametry toksikometrii promyshlennyh jadov pri odnokratnom vozdejstvii [The parameters of toxicometric industrial poisons in a single exposure]: Spravochnik. M.: Medicina, 1977. 240 p.
- 2. Vrednye veshhestva v promyshlennosti [Harmful substances in industry]. Pod red. N.V. Lazareva i Je.N. Levinoj: Spravochnik: V 3 t. T. 3. M.: Himija, 1976. 608 p.
- 3. Kulikov A. N., Orlov S.V., Pimankov S.I. Voda i jekologija. 2002. № 4. pp. 2−8
- 4. Kozhevnikov A.B., Petrosjan O.P. Hlorirovanie — mikrobiologicheskaja i tehnicheskaja bezopasnost' vodopodgotovki [Chlorination, microbiological and technical safety of water treatment]: Materialy XII Mezhdunarodnoj nauchno-prakticheskoj konferencii «Problemy upravlenija kachestvom gorodskoj sredy». Vodnaja bezopasnost' poselenij Rossii. Moskva, 2008. 54 p.
- 5. L.N. Fesenko, V.I. Jeberil', M.S. Lipkin, A.Ju. Skrjabin, I.A. Goncharov, V.S. Spasibova, D. E Pushuk. Inћenernyj vestnik Dona (Rus), 2016. № 4. URL: ivdon.ru/ru/magazine/archive/n2y2016/3638.
- 6. Antonov V. N., Bystrov V.I., Avksent’ev V. V., Jurkov JI. I., Kubasov V. L. Himicheskaja promyshlennost'. 1974. N 8. p. 600−603.
- 7. Bahir V.M. Vodosnabzhenie i kanalizacija. 2009. p. 78.
- 8. Gorodeckij V.V., Pecherskij M.M., Janke V.E., Shub D.M., Losev V. V. Kinetika rastvorenija okisnyh rutenievo-titanovyh anodov pri jelektrolize hloridnyh rastvorov [Kinetics of dissolution of oxide ruthenium-titanium anodes in the electrolysis of chloride solutions]. Jelektrohimija. 1979. T. 15, N 4. pp. 559−562.
- 9. Uzbekov A.A., Klement’eva V.S. Jelektrohimija. 1985. T. 21, N 6. pp. 758−763.
- 10. I.V. Pchel’nikov, S.I. Ignatenko, A.A. Babaev, L.N. Fesenko. Inћenernyj vestnik Dona (Rus), 2014. № 1 URL: ivdon.ru/magazine/archive/n1y2014/2242
- 11. Vestnik BGU. Serija 2, Himija. Biologija. Geografija. Vestnik BSU. Series 2, Chemistry. Biology. Geography]. 2015. № 2. pp. 11−14. URL: elib.bsu.by/handle/123 456 789/152093
- 12. Denton D. A., Harrison J. A., Knowles R. I. Chlorine evolution and reduction on electrodes. Electrochim. Acta, 1979. pp. 521−527.
13. Denton D. A., Harrison J. A., Knowles R. I. Automation of electrode kinetics — IV. The chlorine evolution reaction on a plate electrode. D. A. Denton, J. A. Harrison, R. I. Knowles. Electrochim, Acta, 1980. pp. 1147−1152.