Понятия о растворах

Молярная концентрация © вещества X в растворе — отношение количества растворенного вещества, содержащегося в растворе, к объему раствора. Массовая концентрация © вещества X в растворе — это отношение массы растворенного вещества, содержащегося в растворе, к объему раствора. Используется для веществ, количество вещества которых определить затруднительно (полимеры, природные субстанции), обычно… Читать ещё >
Понятия о растворах (реферат, курсовая, диплом, контрольная)
Растворы — это гомогенные (однородные) системы переменного состава, которые содержат два или более компонентов. Наибольшее значение в медицине имеют жидкие растворы, в которых растворителем является вода. Растворяемое вещество может быть в твердом, жидком или газообразном состоянии.
Процесс растворения является физико-химическим процессом, при котором происходит разрушение структуры растворяемого вещества и распределение его между молекулами растворителя. Одновременно с этим осуществляется взаимодействие молекул растворителя с частицами растворенного вещества (сольватация).
Растворимость — это способность вещества растворяться в том или ином растворителе. Определяется природой вещества и растворителя, условиями осуществления процесса растворения: температурой, давлением. Существует правило — подобное растворяется в подобном. Так, полярные вещества растворяются в полярных растворителях (соли, кислоты, щелочи, низшие спирты — в воде), неполярные вещества растворяются в неполярных растворителях (жиры и масла — в углеводородах).
Насыщенный раствор — это раствор, который содержит максимально возможное количество растворяемого вещества при данных температуре и давлении.
Ненасыщенный раствор — это раствор, в котором при данных температуре и давлении возможно растворение дополнительного количества уже содержащегося в нем вещества.
Растворимость (s) характеризует насыщенный раствор и часто выражается как масса вещества, которую можно растворить в 100 г растворителя при данной температуре.
Существуют различные способы выражения состава раствора.
Массовая доля (со) вещества X в растворе — эго отношение массы растворенного вещества к массе раствора.
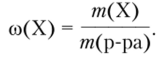 (1.1).
(1.1).

Допускается (в том числе в медицине и фармацевтике) выражать массовую долю в долях единицы, в процентах, % (со -100), в промилле, %о (со -103), в миллионных долях (со -106).
Пример 1.3. В 450 г воды растворили 50 г CuS04 -5H20. Вычислите массовую долю кристаллогидрата, безводной соли и ионов меди в растворе.
Решение. Выразив массу раствора через массы растворителя (вода) и растворенного вещества, запишем:
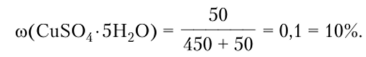
Массовую долю безводной соли определим по уравнению 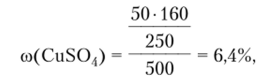 а массовую долю ионов меди в растворе как
а массовую долю ионов меди в растворе как 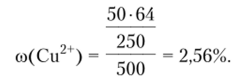
Молярная концентрация © вещества X в растворе — отношение количества растворенного вещества, содержащегося в растворе, к объему раствора.
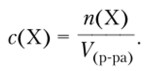
Обычно измеряется в моль/л. Вместо обозначения моль/л допускается обозначение «М». Например, 1 М НС1 — одномолярный раствор НС1; ОДМ — децимолярный раствор; О,(ИМ — сантимолярный раствор.
Молярная концентрация эквивалента С ( 1//экв) — это отношение количества вещества эквивалента в растворе к объему этого раствора.
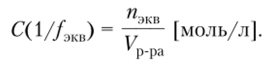
Молярную концентрацию эквивалента в аналитической химии часто называют нормальностью и обозначают как «н», например, 0,2 н H2S04.
Пример 1.4. Вычислите молярную концентрацию и нормальность раствора Н3Р04 с массовой долей кислоты 49% и плотностью 1,33 г/мл. Фактор эквивалентности кислоты принять равным 1/3.
Решение. Приняв объем раствора за 1 л, найдем его массу как произведение объема на плотность:
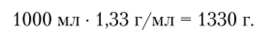
Преобразовав уравнение (1.1) в вид: т (Х) = (Х) т (р-ра), рассчитаем массу фосфорной кислоты в растворе.
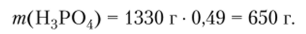
Количество вещества кислоты можно определить по формуле.
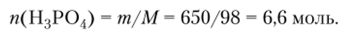
Отсюда молярная концентрация кислоты в 1 л раствора.
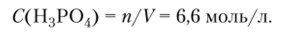
Молярная концентрация эквивалента С'(1/ЗН3Р04) (или нормальность Н3Р04) равна 6,6/(1/3) = 19,8 моль-экв/л.
Массовая концентрация © вещества X в растворе — это отношение массы растворенного вещества, содержащегося в растворе, к объему раствора.
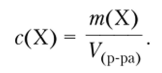
Используется для веществ, количество вещества которых определить затруднительно (полимеры, природные субстанции), обычно измеряется в г/л.
Титр раствора (Т) вещества X: массовая концентрация, выраженная в г/мл (используется в аналитической химии).
Молярная доля (%) компонента X может быть определена как отношение количества вещества этого компонента к суммарному количеству вещества всех компонентов. 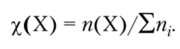
Объемная доля (ф) компонента X — отношение объема этого компонента к суммарному объему раствора.
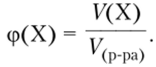
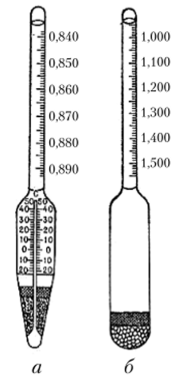
Рис. 1.2. Ареометры (градуированные в единицах плотности):
а — с термометром; 6 — без термометра Применяется для газовых смесей, а также для спиртосодержащих жидкостей.
В растворах, состоящих из одного растворенного вещества и растворителя, существует зависимость между плотностью раствора и его составом (при данной температуре) (табл. 1.1). Это дает возможность определять на практике составы таких растворов с помощью ареометра (рис. 1.2) (денсиметра, спиртометра, сахариметра, лактометра).
Таблица 1.1
Плотность водных растворов NaCl при 20 °C.
со (NaCl), %. | р, г/мл. | со (NaCl), %. | р, г/мл. | со (NaCl), %. | р, г/мл. |
0,00. | 1,000. | 5,50. | 1,038. | 11,00. | 1,078. |
0,50. | 1,003. | 6,00. | 1,041. | 11,50. | 1,082. |
1,00. | 1,005. | 6,50. | 1,045. | 12,00. | 1,086. |
1,50. | 1,009. | 7,00. | 1,049. | 12,50. | 1,089. |
2,00. | 1,013. | 7,50. | 1,053. | 13,00. | 1,093. |
2,50. | 1,017. | 8,00. | 1,056. | 13,50. | 1,097. |
3,00. | 1,020. | 8,50. | 1,060. | 14,00. | 1,101. |
3,50. | 1,024. | 9,00. | 1,063. | 14,50. | 1,105. |
4,00. | 1,027. | 9,50. | 1,067. | 15,00. | 1,109. |
4,50. | 1,031. | 10,00. | 1,071. | 15,50. | 1,113. |
5,00. | 1,034. | 10,50. | 1,074. | 16,00. | 1,116. |