Адсорбция ионов; строение двойного электрического слоя

Следует иметь в виду, что при высоких потенциалах поверхности на малых расстояниях от нее выражение (III. 12) нужно заменить более точным (III.8), учитывающим строение полной части слоя противоионов, в том числе их собственный размер. Нетрудно видеть, что предельное выражение (ШЛО) может быть получено, если интегрирование уравнения Пуассона — Больцмана распространить до самой поверхности твердой… Читать ещё >
Адсорбция ионов; строение двойного электрического слоя (реферат, курсовая, диплом, контрольная)
Многие свойства дисперсных систем связаны с особенностями распределения заряда вблизи поверхности раздела фаз при адсорбции электролитов. Специфика адсорбции электролитов обусловлена относительно более дальнодействующим характером электростатических (кулоновских) взаимодействий ионов по сравнению с вандер-ваальсовским взаимодействием молекул. Это (с учетом теплового движения) вызывает большую размытость межфазных слоев, образованных ионами, сравнительно с молекулярными адсорбционными слоями, благодаря чему поверхность разрыва приобретает заметную толщину. С таким диффузным характером ионизированных адсорбционных слоев связаны важнейшие свойства дисперсных систем, в частности возникновение электрокинетических явлений (гл. IV) и устойчивость дисперсных систем (гл. VII, VIII). Другой существенной особенностью адсорбционных явлений в растворах электролитов (как правило водных) является то обстоятельство, что адсорбция всегда имеет конкурентный характер — помимо растворителя в системе присутствует по крайней мере два типа ионов (а с учетом диссоциации молекул растворителя — три или четыре), и конкуренция между ними определяет характер строения поверхности разрыва в подобных системах — возникновение пространственного разделения зарядов, называемого двойным электрическим (правильнее — ионным) слоем. Строение двойного электрического слоя подробно рассматривается в курсе электрохимии; в приводимом ниже рассмотрении основной акцент делается на тех аспектах проблемы, которые наиболее существенны для коллоидной химии.
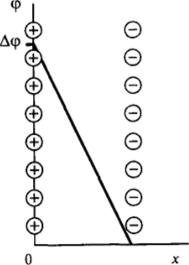
Рис. Ш-8. Схема строения двойного электрического слоя по Гельмголыху
В соответствии с простейшей моделью Гельмгольца пространственное разделение зарядов вблизи поверхности может рассматриваться как двойной электрический (ионный) слой, представляющий собой две параллельные обкладки заряженного конденсатора, разделенные прослойкой дисперсионной среды с некоторой средней (эффективной) толщиной 5. Одна обкладка конденсатора образована потенциалопределяющими ионами, закрепленными на самой поверхности, другая — противоионами, находящимися в среде. При этом ионы, одноименно заряженные с поверхностью — так называемые коионы, оттеснены в объем раствора. Такое разделение зарядов приводит к возникновению разности потенциалов Дер между контактирующими фазами и (в данной модели) к линейному падению потенциала между обкладками конденсатора (рис. II1−8).
Современная теория строения двойного электрического слоя, развитая в трудах Г. Гуи, Д. Чепмена, О. Штерна, А. Н. Фрумкина, Д. Грэма и др., основана на анализе электростатических взаимодействий ионов в двойном электрическом слое в сопоставлении с межмолекулярными взаимодействиями и тепловым движением ионов.
Как известно из электрохимии, равновесие в системе, в которой контактирующие фазы имеют разные электрические потенциалы ср, определяется условием равенства электрохимических потенциалов ионов связанных с их химическими потенциалами ц, соотношением.
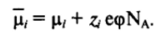
Здесь Z/ е — заряд иона (с учетом знака); е — заряд электрона; NA — число Авогадро; произведение eNA — число Фарадея.
При малой концентрации ионов щ (число ионов/м3) условию равновесия отвечает постоянное значение электрохимического потенциала по всей системе, т. е.
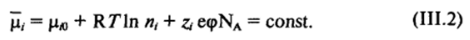
Такая запись учитывает три основных фактора, определяющих поведение ионов в системе: их молекулярное взаимодействие с окружающей средой рл, участие в тепловом движении R Лп л, и взаимодействие с электрическим полем zj ефЫд. Соотношение (III.2) должно выполняться для всех ионов, присутствующих в системе. Иногда какие-либо ионы практически отсутствуют в одной из фаз или в обеих контактирующих фазах. В последнем случае ионы присутствуют только на поверхности раздела фаз (поверхностная диссоциация, характерная для неорганических веществ сложного строения, например силикатных и алюмосиликатных минералов). Кроме того, возможна поляризация поверхности, когда для одного из ионов из-за кинетических затруднений электрохимическое равновесие не устанавливается, и разность потенциалов между фазами без изменения их состава может быть задана приложением внешней разности потенциалов.
В отсутствие поляризации поверхности изменение разности потенциалов между фазами всегда связано с изменением состава фаз; дифференцирование соотношения (III.2) приводит в этом случае к уравнению Нернста: 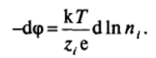
Заметим, что фигурирующая здесь разность потенциалов между фазами <�р не может быть определена экспериментально, тогда как ее изменения измеряются сравнительно просто.
Вблизи поверхности раздела фаз величины цд для различных ионов меняются от значений, соответствующих объему одной фазы, до значений, характерных для объема другой фазы. Это приводит к перераспределению ионов между объемами фаз и поверхностью так, что зависимость ф (х) приобретает более сложный характер по сравнению с моделью Гельмгольца. Обычно рассматривают величину потенциала поверхности твердой фазы относительно дисперсионной среды сро, абсолютное значение которого нельзя определить экспериментально. Если в твердой фазе нет преимущественного концентрирования ионов одного знака у поверхности, потенциал сро равен разности потенциалов между фазами. Как и в объеме фаз, поведение ионов вблизи поверхности раздела обусловливается тремя факторами, определяющими строение двойного электрического слоя: силами адсорбционного взаимодействия (специфическими и неспецифическими) ионов с поверхностью раздела фаз, электростатическими взаимодействиями ионов с заряженной поверхностью и друг с другом, а также тепловым движением ионов.
Вследствие малого радиуса действия адсорбционных сил можно, до некоторой степени условно, выделить в двойном электрическом слое две основные части (рис. Ш-9): более близкую к поверхности «плотную» часть (слой Штерна—Гельмгольца), где адсорбционные силы существенны, и более удаленную «диффузную» часть (слой.
Рнс. III-9. Схема строения двойного электрического слоя.
Гуи — Чепмена), где ими можно пренебречь. Главной задачей теории строения двойного электрического слоя является количественное описание распределения концентрации присутствующих в системе ионов я*, и электрического потенциала ф в любой точке раствора в зависимости от расстояния до поверхности х.
Возникновение двойного электрического слоя происходит вследствие установления адсорбционного равновесия в системе, приводящего к возникновению на поверхности слоя потенциалопределяющих ионов. Можно выделить следующие причины такого возникновения слоя потенциалопределяющих ионов.
- 1. Избирательная адсорбция ионов из раствора. При этом преимущественно адсорбируются ионы, имеющие высокий адсорбционный потенциал, и в первую очередь присутствующие в дисперсионной среде ионы, способные «достраивать» поверхность твердой фазы. В классическом примере формирования слоя потенциалопределяющих ионов на поверхности кристаллов Agl ионами Г в растворе KI или ионами Ag* в растворе AgNCb движущей силой такой достройки является специфическое химическое взаимодействие ионов с поверхностью кристалла.
- 2. Ионизация молекул вещества твердой фазы (например диссоциация поверхностных групп силикатов в водной среде).
- 3. Переход какого-либо иона из одной фазы в другую при установлении электрохимического равновесия (например, при опускании пластинки серебра в раствор AgNC>3 с достаточно малой концентрацией ионов Ag происходит переход ионов Ag+ из металла в раствор и на поверхности металла возникает отрицательный заряд).
- 4. Поляризация поверхности при помощи внешнего источника тока (например, заряжение поверхности ртути в растворах электролитов).
По схеме Штерна — Грэма, плотная часть двойного электрического слоя (слой Штерна — Гельмгольца), примыкающая к заряженной потенциалопределяющими ионами поверхности, в свою очередь, может состоять из внутренней и внешней частей. Внутренняя часть, расположенная непосредственно вблизи заряженной поверхности, образована специфически адсорбирующимися на данной поверхности частично или полностью дегидратированными ионами (внутренняя плоскость Гельмгольца). Внешнюю часть составляют гидратированные ионы, не проявляющие столь энергичной специфической адсорбции (внешняя плоскость Гельмгольца). Специфически адсорбирующиеся ионы, входящие в состав внутренней части слоя Штерна — Гельмгольца, могут иметь как противоположный, так и одинаковый с потенциалопределяющими ионами знак. Это зависит от соотношения энергии электростатического взаимодействия ионов с заряженной поверхностью Zi ечц (ср<*, — потенциал на границе внутренней час. ти слоя Штерна — Гельмгольца) и энергии их специфического молекулярного взаимодействия с поверхностью Ф,.
При обсуждении закономерностей проявления двойных электрических слоев в коллоидно-химических процессах в дисперсных системах можно в большинстве случаев ограничиться рассмотрением слоя Штерна — Гельмгольца как единого целого слоя толщиной d
(см. рис. Ш-9). Разделение плотного слоя на две части может быть существенным при анализе электрохимических явлений.
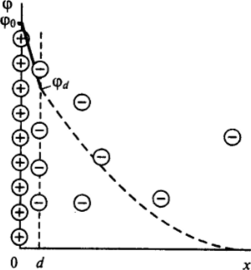
Следуя Штерну, для определения заряда плотного слоя можно воспользоваться рассмотренной в гл. II схемой мономолекулярной адсорбции Ленгмюра. В этом случае работа перенесения /-го иона из объема раствора в плотную часть двойного слоя W^x * d) должна включать как величину Ф, отражающую чисто адсорбционное взаимодействие иона с поверхностью (см. гл. II, 2), так и работу сил электростатического взаимодействия иона с заряженной поверхностью Z?q>t, где.
z, сер, /(к 7) и зависимость адсорбции /-го иона Г, от его объемной концентрации п0 может быть описана соотношением.
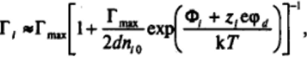
где 2d — толщина адсорбционного слоя; re — предельная адсорбция, определяемая числом адсорбционных центров на единицу поверхности. Из-за сильного взаимного отталкивания ионов высокие значения адсорбции, соизмеримые с Г^, как правило, не достигаются, и можно использовать приближенное соотношение, отвечающее начальной линейной области изотермы адсорбции Ленгмюра,.
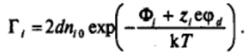
Тогда общее число зарядов на единицу поверхности (поверхностная плотность зарядов) р, в слое Штерна — Гельмгольца равно:
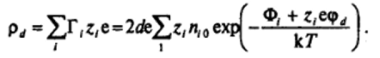
Следовательно, и в отсутствие специфической адсорбции (при Ф, = 0) заряд плотного слоя не равен нулю: в этом случае плотный слой образован противоионами, удерживаемыми вблизи поверхности только электростатическими силами.
Применяя теорему Остроградского — Гаусса для определения плотности заряда поверхности ps в плоскости (х = 0) и полагая, что в плотном слое от х = 0 до х = d происходит линейное изменение потенциала, можно написать:
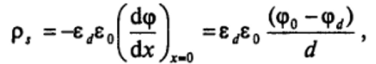
где zd — диэлектрическая проницаемость в слое Штерна — Гельмгольца, которая может быть значительно ниже диэлектрической проницаемости среды. Величина Cd = р,/(ср0
d) *= zjzjd есть интегральная емкость слоя Штерна — Гельмгольца, соответствующая емкости плоского конденсатора, образованного заряженной поверхностью и ионами плотного слоя. Из условия электронейтральности двойного слоя в целом следует:
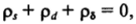
где р, — заряд диффузной части двойного слоя, приходящийся на единицу поверхности.
При исследовании дисперсных систем определение адсорбционных потенциалов Ф, различных ионов представляет значительные трудности и не всегда может быть осуществлено; невозможно также измерить и величину <�рЛ что ограничивает применимость количественных расчетов по теории Штерна — Грэма в коллоидной химии. Вместе с тем представления этой теории позволяют объяснить некоторые случаи перезарядки поверхности при введении электролитов. Такие явления обнаруживаются при измерении электрокинетического потенциала С, — величины, близкой к потенциалу плотного слоя (pd (см. IV.2).
Рассмотрим изменение потенциала <�рв диффузной ч, а с — т и двойного электрического слоя, приняв, что в объеме дисперсионной среды ф = 0. Теоретическое описание этой части двойного электрического слоя принадлежит Гуи и Чепмену, которые сопоставили энергию электростатического взаимодействия ионов с энергией их теплового движения, допустив, что распределение концентрации ионов в двойном электрическом слое подчиняется уравнению Больцмана:
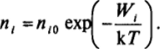
Тем самым было использовано приближение идеального раствора ионов. Другое допущение, сделанное Гуи и Чепменом, предполагает, что величина IV/ в диффузной части слоя имеетчисто электростатический характер и равна работе переноса заряда zfi из бесконечно удаленных от поверхности областей раствора в данную точку (х, у, г):
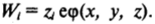
Следовательно, концентрация i'-го иона может быть определена выражением 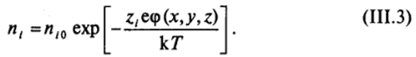
В области диффузной части двойного слоя концентрация противоионов повышена (знаки zi и <�р противоположные) и уменьшается до объемного значения по мере удаления от поверхности (рис. 111−10). Наоборот, концентрация коинов, заряженных одноименно с поверхностью (знаки Zj и ф одинаковые), понижена и возрастает при удалении от поверхности. Такое обогащение диффузной части двойного слоя противоионами и обеднение коионами приводит к возникновению избыточной объемной плотности заряда ру, которую можно определить суммированием выражений (II1.3) по всем видам ионов, присутствующих в дисперсионной среде 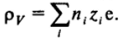 Связь объемной плотности заряда pvc распределением потенциала описывается уравнением Пуассона:
Связь объемной плотности заряда pvc распределением потенциала описывается уравнением Пуассона:
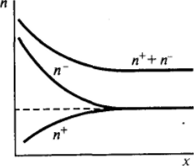
Рис. III-10. Изменение концентрации Кононов л противоионов п и суммарной концентрации ионов л = п + п в диффузной части двойного электрического слоя.
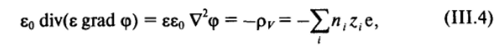
где V2 — оператор Лапласа; е — диэлектрическая проницаемость, которая принимается постоянной.
Подставляя в (III.4) выражение для л, из (III.3), получаем у р, а в — нение Пуассона—Больцмана — основное уравнение теории диффузной части двойного электрического слоя:
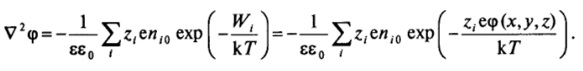
Для двойного слоя у плоской поверхности уравнение Пуассона — Больцмана можно записать в виде.
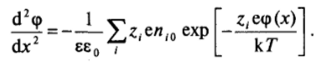
Обычно рассматривают простейший случай симметричного электролита (г+ = = z; п?}= «о» '= яо)> ПРИ этом 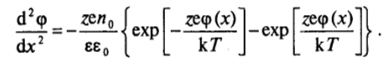
Используя гиперболические функции1, можно упростить уравнение Пуассона — Больцмана для плоского слоя, записав его в виде.
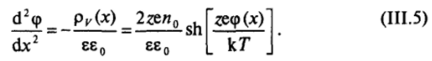
Полученное дифференциальное уравнение второго порядка должно решаться при следующих краевых условиях:
1) для границы диффузного слоя с плотным слоем Штерна — Гельмгольца.
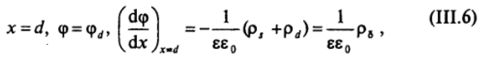
где р8 — заряд диффузного слоя, приходящийся на единицу площади поверхности:
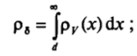
2) для объема раствора.
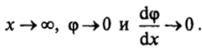
Первое интегрирование уравнения (III.5) можно провести, умножив обе его части на (dqp/dx) dx. Учитывая тождество.
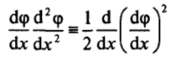
и принимая во внимание, что 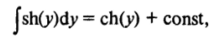 имеем.
имеем.
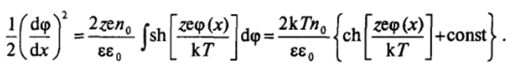
1 Основные гиперболические функции: синус sh (y) = (ev — еу)/2; косинус ch (y) = (е> + е_у)/2; тангенс th (y) = sh (y)/ch (y) « (е? - е~')/(еу + «» О « (г — + 1).
При у " 1 sh (y) «lh (y) ту; а также chO>) «1 + У/2. При у » 1 th (y) * 1.
Воспользовавшись краевыми условиями <�р = 0 и d.
х -> °о, находим, что const = - ch (0) = - 1. Учитывая, что.
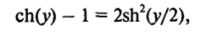
получаем.
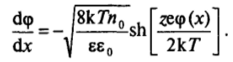
В этом выражении оставлен знак минус, так как знаки при <�р (х) и с!<�р/с1хдолжны быть противоположными (см. рис. Ш-8). Отметим, что быстрота спада потенциала <�р с удалением от поверхности тем больше, чем выше концентрация электролита п0.
Этот первый интеграл уравнения Пуассона — Больцмана (III.5) при подстановке в него условия (III.6) дает выражение для заряда диффузного слоя на единицу поверхности:
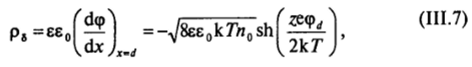
знак минус подчеркивает, что при положительном потенциале поверхности х = d (границы плотного слоя) противоионы в диффузном слое несут отрицательный заряд.
Второе интегрирование уравнения Пуассона — Больцмана (III.5) проводим, учитывая, что.
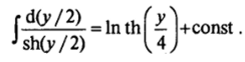
Используя краевое условие <�р =.
rf при х = d, находим.
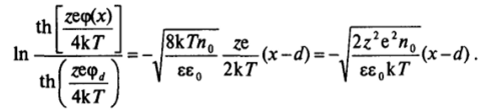
Преобразуя это выражение, получаем 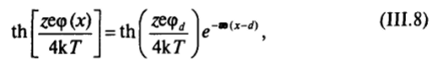 где.
где.
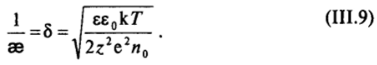
Величина 8 = 1/ае, называемая толщиной (эффективной) ионной атмосферы, была введена в теории сильных электролитов Дебая — Хюккеля, развитой позже теории Гуи — Чепмена.
В дальнейшем, для упрощения выражений, можно не делать различия между потенциалами <�ро и ср^ и записывать выражения (III.8) и (III.7) в приближенном виде:
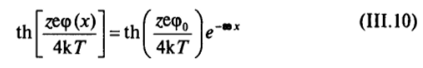
и.
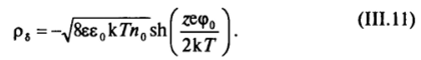
Такое упрощение справедливо лишь при слабой адсорбционной способности ионов и для сильно разбавленных растворов, когда из-за большой толщины диффузной части двойного слоя 8 потенциал.
d на расстоянии d « 8 от поверхности лишь слабо отличается от ро-потснциала. Замена р</на ро не может привести к существенным недоразумениям, поскольку при необходимости всегда можно без затруднений возвратиться к выражениям вида (III.8) и (III.7).
Для анализа коллоидно-химических явлений особенно важно поведение функции р (х) на достаточно больших расстояниях от поверхности, где величина р мала по сравнению с 4к7/(ге). При малых значениях аргумента гиперболический тангенс приближенно равен своему аргументу. Следовательно, при zep (x)/(4k7) «1 уравнение (ШЛО) можно представить в виде.
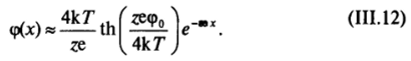
В случае слабозаряженной поверхности, когда и величина ро мала в сравнении с 4к77(ге), выражение (Ш.10) еще более упрощается, принимая вид.

т. е. потенциал в диффузном слое пропорционален потенциалу поверхности и экспоненциально падает с расстоянием от поверхности.
В этом случае и гиперболический синус в уравнении (III. 11) тоже можно заменить на аргумент zecpo/(2k7). Тогда для плотности заряда диффузного слоя получаем.
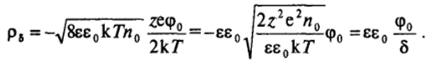
Это выражение соответствует зависимости плотности заряда от потенциала для обычного конденсатора с плоскими обкладками и емкостью на единицу площади, равной С, = ее0/5 = Бе0эв. Величину 5 = 1/ав, характеризующую расстояние между обкладками такого плоского конденсатора, называют эффективной толщиной диффузной части двойного слоя.
Величина аз, обратная толщине ионной атмосферы, характеризует резкость спада потенциала по мере удаления от поверхности [см. (III.12) и (III. 18)]: чем выше концентрация электролита в системе и соответственно больше значение as, тем более резко спадает потенциал при удалении от поверхности раздела фаз (рис. III-11). Для одно-одновалентного электролита расчет по уравнению (III.9) приводит к значениям толщины ионной атмосферы 8 «3 • Ю-|0с,/2 м (если концентрация с = ho/Na выражена в кмоль/м3). Для одномолярного раствора 5 «0,3 нм, для сантимолярного 8 = 3 нм, тогда как для раствора с концентрацией 1(Г7 моль/л б = 1 мкм.
Для сильно заряженной поверхности, когда Фо «4к77(ге), имеем И1(геф0Д7) «1. Следовательно,.
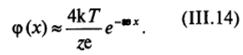 aside class="viderzhka__img" itemscope itemtype="http://schema.org/ImageObject">
aside class="viderzhka__img" itemscope itemtype="http://schema.org/ImageObject">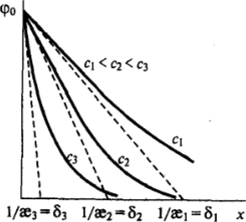
Рис. 111-11 Влияние концентрации электролитов на падение потенциала ф (дг) в двойном электрическом слое
Сопоставление выражений (III. 12) и (III.13) показывает, что на больших расстояниях от поверхности всегда происходит экспоненциальный спад потенциала с расстоянием, при этом для слабозаряженной поверхности ф (х) ~ фо, тогда как для сильно заряженной поверхности ее потенциал фо не влияет на распределение потенциала в удаленных от поверхности частях диффузного слоя. Последнее обстоятельство связано с сильным взаимодействием противоионов с сильно за;
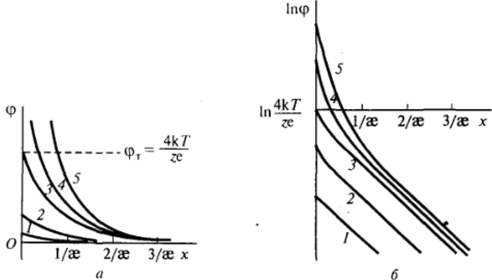
Рис. III-12. Зависимость потенциала <�р (а) и его логарифма (б) от расстояния от поверхности при различных значениях <�р0-потенциала.
ряженной поверхностью; находящиеся вблизи такой поверхности противоионы значительно экранируют ее заряд. Таким образом, распределение потенциала вдали от сильно заряженной стенки зависит от толщины ионной атмосферы 6 и величины <�рг = 4кТ/(&), которая определяет способность теплового движения (характеризуемого величиной к7) противодействовать стремлению ионов к электростатическому притяжению к поверхности (определяемому зарядом ионов ге). Это простое и ясное по своему физическому смыслу приближение, часто используемое в коллоидной химии, позволяет при описании диффузной атмосферы противоионов не вникать в детали строения плотной части двойного слоя. При комнатной температуре для одно-однозарядного электролита <�рг" 100 мВ.
На рис. III-12, а показано, как меняется зависимость ср (х) при последовательном увеличении потенциала фо. Изменение характера падения потенциала при удалении от поверхности по мере увеличения заряда поверхности видно в полулогарифмических координатах (рис. III-12, б). При малых потенциалах поверхности зависимости 1пф — х представляют собой параллельные прямые 1 и 2с тангенсом угла наклона, равнымае. При больших значениях фо кривые 4п5на малых расстояниях идут более круто, а вдали от поверхности стремятся к одной общей прямой, параллельной прямым для малых фоПродолжение этой предельной прямой до оси ординат дает значение 1пф7-.
На рис. Ill-13 представлена зависимость потенциала на некотором постоянном расстоянии х > 6 = 1/эе от потенциала поверхности <�ро. Начальная и конечная асимптоты соответствуют приближенным уравнениям (III. 13) и (111.14) и достаточно хорошо описывают свойства удаленных частей диффузного слоя (в точке пересечения асимптот при <�р0 = фгистинное значение потенциала на -20 % ниже приближенного). Таким образом, при больших удалениях от поверхности потенциал данной фиксированной точки х при малых значениях потенциала поверхности <�ро пропорционален, а при больших — не зависит от фо (или, в общем случае, от ф</).
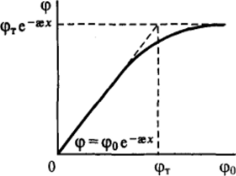
Рнс. III-13. Зависимость потенциала ср от ф0-потенциала на некотором расстоянии х> 1/ав
Итак, строение диффузной части двойного слоя определяется соотношением потенциальной энергии притяжения противоионов к заряженной поверхности и кинетической энергии их теплового движения, характеризуемым безразмерной величиной гефо/4кГ (или геф/4к7).
Когда потенциальная энергия притяжения ионов к поверхности мала (гефо/(4к7) 1), то основная компенсация поверхностного заряда происходит непосредственно вблизи поверхности — противоионы, близко расположенные к поверхности, сильно экранируют ее заряд. Вдали от поверхности при этом также происходит экспоненциальное падение потенциала с увеличением расстояния, но величины потенциалов перестают зависеть от потенциала самой поверхности.
Следует иметь в виду, что при высоких потенциалах поверхности на малых расстояниях от нее выражение (III. 12) нужно заменить более точным (III.8), учитывающим строение полной части слоя противоионов, в том числе их собственный размер. Нетрудно видеть, что предельное выражение (ШЛО) может быть получено, если интегрирование уравнения Пуассона — Больцмана распространить до самой поверхности твердой фазы х = 0, т. е. считать, что центры ионов могут подходить непосредственно к поверхности. Вместе с тем это не отражается существенно на характере распределения потенциала на больших расстояниях от поверхности, особенно в тех случаях, когда потенциал адсорбционного слоя ср 1. Именно эти удаленные части диффузных слоев противоионов в некоторых случаях определяют устойчивость дисперсных систем (см. гл. VII, VIII).
Существование вблизи заряженной поверхности диффузного слоя с повышенной концентрацией противоионов и пониженной концентрацией коинов обусловливает многие особенности электрических и фильтрационных свойств дисперсных систем. Существенным оказывается и то, что в диффузном слое повышена общая концентрация носителей тока (см. рис. III-10). Так, для простейшего случая симметричного электролита в соответствии с (И 1.8) можно написать:
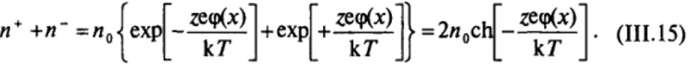
Проведенное рассмотрение относится к плоскому двойному слою на границе раздела фаз. Для дисперсных систем оно применимо, когда размер частиц дисперсной фазы значительно превышает толщину ионной атмосферы и двойные слои могут считаться плоскими. Если это условие не соблюдается, уравнение Пуассона — Больцмана следует записывать в полном виде:
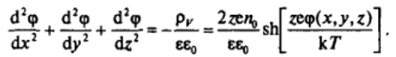
Это уравнение не решается в квадратурах даже в простейших случаях сферических и цилиндрических частиц и требует привлечения специальных функций; результаты численного интегрирования при различной геометрии системы табулированы в широком интервале потенциалов поверхности и толщин ионных атмосфер.
Приближенное решение уравнения Пуассона — Больцмана для сферических частиц радиусом г было проведено П. Дебаем и Э. Хюккелем для слабозаряженных частиц, когда zeq>(/k7'< 1 и sh (ze.
<�рДГ. Для этого случая уравнение Пуассона — Больцмана принимает вид.
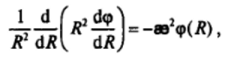
где R — расстояние от центра частицы в сферических координатах. Решением этого уравнения является зависимость.
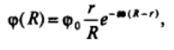
которая отражает как «обычное* уменьшение потенциала при удалении от заряженной сферы (сомножитель г/К), так и более быстрый спад потенциала, связанный с существованием диффузного слоя (экспоненциальный сомножитель). Вследствие этого спад потенциала при удалении от поверхности заряженной частицы, окруженной диффузным слоем, происходит быстрее, чем вблизи поверхности заряженной частицы в диэлектрической среде или вблизи плоской поверхности с диффузным слоем. Можно сказать, что «наибольшее развитие» вокруг заряженной частицы имеют удаленные области с малыми потенциалами, тогда как области с высокими потенциалами занимают малый объем непосредственно вблизи поверхности частицы. Для сильно заряженных частиц вдали от их поверхности, как показывает сопоставление с результатами численных расчетов, может быть использовано выражение, аналогичное (III. 14), имеющее вид.
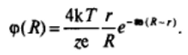
В дальнейшем (в частности, при анализе устойчивости дисперсных систем) рассмотрение для простоты будет ограничиваться случаем плоских двойных электрических слоев.