Физические свойства и получение простых веществ

Простые вещества Х2 получают окислением галогенов в их соединениях с металлами и водородом. Рассмотрим типичные реакции на примере получения хлора. В лаборатории хлор наиболее просто получить действием соляной кислоты на перманганат калия. При добавлении концентрированной соляной кислоты к кристаллам перманганата калия смесь вспенивается, и выделяется зеленоватый газ с резким запахом: Бром… Читать ещё >
Физические свойства и получение простых веществ (реферат, курсовая, диплом, контрольная)
Все галогены в виде простых веществ имеют одинаковый тип молекул — Х2. Их правильные номенклатурные названия дифтор, дихлор и т. д. применяются редко. Фтор и хлор при обычных условиях представляют собой газы, бром — жидкость, а иод — твердое вещество. Все галогены — окрашенные вещества (табл. 18.1). Над поверхностью жидкого брома образуется пар интенсивного бурого цвета. Иод в твердом состоянии заметно летуч, и уже при слабом нагревании появляется фиолетовая окраска его паров. Происходит сублимация иода. Мелкие черные кристаллы иода, оставленные на стекле, через некоторое время полностью сублимируют и исчезают.
Таблица 18.1
Свойства галогенов в виде простых веществ.
Свойство. | Фтор F2 | Хлор С12 | Бром Вг2 | Иод 12 |
Агрегатное состояние. | Газ. | Газ. | Жидкость. | Твердое вещество. |
Цвет. | Светло; желтый. | Желто; зеленый. | Красно-коричневый. | Черный (пар фиолетовый). |
t °С | — 220. | — 101,5. | — 7,2. | 113,7. |
t °с ^кип". | — 188. | — 34,0. | 58,8. | 184,4. |
Растворимость в воде (20°С) со, %. | Разлагает воду. | 1,4. | 3,5. | 0,03. |
Свойство. | Фтор F2 | Хлор С12 | Бром Вг2 | Иод 12 |
Энергия связи Х-Х, кДж/моль. | ||||
Расстояния Х-Х в молекулах, пм. | ||||
Электродный потенциал ср° пары Х2/2Х", В. | 2,87. | 1,358. | 1,087. | 0,5355. |
Галогены имеют запах, по которому обнаруживается даже небольшая примесь их в воздухе. Запах хлора известен по запаху выделяющей его хлорной извести, а запах иода — по аптечной настойке.
В молекулах всех галогенов имеются простые ковалентные связи. Прочность их относительно невелика, вследствие чего галогены химически очень активны. Для сравнения можно отметить, что в молекуле водорода с одинарной связью энергия связи 436 кДж/моль, т. е. приблизительно вдвое больше, чем в самой устойчивой молекуле хлора. Это связано с меньшим межъядерным расстоянием в молекуле Н2 и отсутствием прочих электронов, кроме связывающей электронной пары.
Простые вещества Х2 получают окислением галогенов в их соединениях с металлами и водородом. Рассмотрим типичные реакции на примере получения хлора. В лаборатории хлор наиболее просто получить действием соляной кислоты на перманганат калия. При добавлении концентрированной соляной кислоты к кристаллам перманганата калия смесь вспенивается, и выделяется зеленоватый газ с резким запахом:
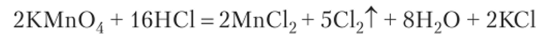
Если заменить соляную кислоту раствором хлорида натрия, то реакция не идет. Но при добавлении к смеси КМп04 и NaCl капли серной кислоты начинает выделяться хлор. Из этого следует, что в нейтральной среде окислительное действие перманганата калия недостаточно для окисления ионов хлора.
Хлор выделяется также при нагревании черного порошка оксида марганца (1У) с соляной кислотой:
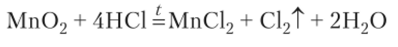
Эта реакция удобна для периодического получения хлора, так как без нагревания она прекращается.
Еще один способ получения хлора основан на реакции между соединениями хлора в положительной и отрицательной степени окисления:
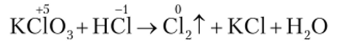
Рекомендуем составить уравнение этой реакции.
Хлороводород может окисляться до С12 и другими окислителями (РЬ02, К2Сг207, КСЮ). Кислород при обычных условиях с хлороводородом не реагирует. Но при пропускании смеси хлороводорода и кислорода по трубке, в которую помещен катализатор СиС12, на гранулах пемзы при 400 °C наблюдается окисление хлороводорода:
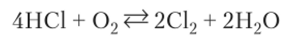
Выход хлора при этой температуре достигает 80%.
В промышленности хлор получают в больших количествах электролизом раствора хлорида натрия.
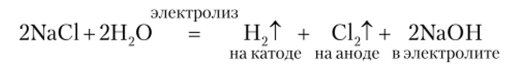
Кроме хлора при электролизе получаются еще два важных для хозяйственного использования продукта — водород и гидроксид натрия.
Хлор используется на водоочистительных станциях для обеззараживания питьевой воды; для получения хлорорганических соединений разнообразного назначения, хлорной извести, гипохлоритов. Мировое производство хлора превышает 50 млн т в год.
Те же типы химических реакций пригодны для получения брома и иода. Эти галогены окисляются легче, чем хлор. Практически наиболее простым способом получения Вг2 и 12 является окисление бромидов и иодидов в водном растворе пропусканием газообразного хлора:
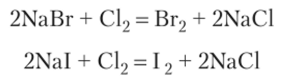
При получении брома окраска бесцветного исходного раствора постепенно усиливается до красно-оранжевой, и на дне сосуда начинает скапливаться бром в виде тяжелой бурой жидкости. При получении иода молекулы 12 сначала соединяются с не вступившими в реакцию ионами I-, образуя растворимое соединение Nal3 с интенсивной красно-бурой окраской:
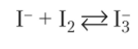
В конце реакции при снижении концентрации I- молекулы 12 освобождаются и выпадает черный осадок кристаллического иода, а раствор становится светло-желтым.
Бром используют для получения различных бромидов. Около половины всего производимого брома идет на получение дибромэтана С2Н4Вг2. Мировое производство брома составляет более 300 тыс. т в год. Иод находит применение в органическом синтезе, в технологии получения особо чистых металлов и в медицине. Ежегодно производится более 15 тыс. т иода.
Получение фтора принципиально отличается от получения остальных галогенов тем, что никакие химические окислители не могут окислить фториды и другие соединения фтора до простого вещества. Поэтому фтор получают только электролизом расплавленных фторидов. Обычно применяют кислый фторид калия KFHF, плавящийся при 240 °C. При избытке фтороводорода процесс электролиза идет при температуре около 100 °C с применением графитовых электродов. Фтор применяется для фторирования органических соединений и производства химически стойких пластмасс — фторопластов. В современной технике и приборостроении широко применяются и неорганические соединения фтора. Мировое производство фтора составляет около 5 млн т в год.