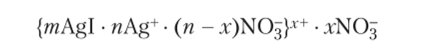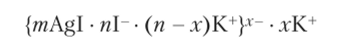Коагулирующее действие ионов. Порог коагуляции
Повторим, что коагуляцией называют самопроизвольное укрупнение (слипание) частиц твердой дисперсной фазы в золях. Коагуляция происходит, когда силы притяжения между частицами превышают силы отталкивания, причем для этого достаточно снижение-потенциала не до нуля, а до критического значения 0,02—0,03 В.
" Совместное действие сил притяжения и отталкивания описывается теорией ДЛФО, см. параграф 4.2.
Коагуляция связана с уменьшением толщины диффузного слоя и, следовательно, с усилением электростатического взаимодействия между ядром коллоидной частицы и противоионами. Сила такого взаимодействия в соответствии с законом Кулона прямо пропорциональна зарядам (ядра коллоидной частицы и противоионов) и обратно пропорциональна квадрату расстояния между их центрами.
Наименьшая концентрация электролита, при которой начинается коагуляция, называется порогом коагуляции Ск. Экспериментально Ск определяют визуально по помутнению раствора или выпадению осадка, а также фотоколориметрически, измеряя оптическую плотность.
?? На практике с фотоколориметрическим способом определения порога коагуляции вы познакомитесь при выполнении лабораторной работы 2 «Определение порогов коагуляции золей электролитами» (см. параграф Л.2).
Коагулирующее действие оказывают только ионы, противоположные по заряду ядру коллоидной частицы. Золь строения.
будет коагулировать под действием анионов, а золь строения.
— под действием катионов. Таким образом, коагуляция золя может произойти под действием любого электролита, поскольку в растворе любого электролита имеются и анионы, и катионы.
Введение
в золь раствора NaCl вызовет коагуляцию любого из этих двух золей, но в первом случае иономкоагулятором является С1~, а во втором — Na+.
Резюме
Коагулирующим действием обладают ионы, противоположные по знаку заряда коллоидной частице. Наименьшая концентрация электролита, при которой начинается коагуляция, называется порогом коагуляции.