Фазовые переходы.
Теплотехника в 2 т. Том 1. Термодинамика и теория теплообмена

В паросиловых и холодильных установках рабочим телом являются соответственно водяной пар и пары различных низкокипящих хладагентов (аммиака, фреона и т. д.), которые при давлениях и температурах, применяемых в них, не могут быть отнесены к идеальным газам. При этих параметрах становится существенным влияние в указанных рабочих телах сил взаимодействия между молекулами и собственного объема… Читать ещё >
Фазовые переходы. Теплотехника в 2 т. Том 1. Термодинамика и теория теплообмена (реферат, курсовая, диплом, контрольная)
Гомогенная система и каждая фаза гетерогенной системы могут состоять из одного или нескольких чистых веществ. Системы, состоящие из нескольких веществ, называются раствором или смесью.
Все чистые вещества и растворы могут находиться в трех агрегатных состояниях: газообразном, жидком и твердом.
В простых системах могут протекать частые процессы при постоянстве одного параметра. Например, в изотермическом процессе меняются объем и давление.
В сложных системах процессы протекают при постоянстве двух параметров. Например, процесс испарения происходит обычно при р = const и Т- = const. При протекании химической реакции в сосуде v = const при Т = const надо подводить теплоту (эндотермические реакции) или отводить теплоту (экзотермические реакции).
Фазовым переходом называется переход вещества из одной фазы в другую, сосуществующую с первой, в том числе изменение агрегатного состояния. При этих превращениях скачком меняется плотность р = 1/v, превращения сопровождаются тепловым эффектом: имеют скрытую теплоту фазового превращения. Например, при переходе вещества из жидкой фазы в газообразную теплота фазового перехода тратится как на работу расширения, так и на преодоление сил межмолекулярного взаимодействия, на разрушение ассоциированных комплексов молекул (q = Аи + /). При плавлении или сублимации теплота фазового перехода тратится на разрушение кристаллической решетки.
В паросиловых и холодильных установках рабочим телом являются соответственно водяной пар и пары различных низкокипящих хладагентов (аммиака, фреона и т. д.), которые при давлениях и температурах, применяемых в них, не могут быть отнесены к идеальным газам. При этих параметрах становится существенным влияние в указанных рабочих телах сил взаимодействия между молекулами и собственного объема молекул. Расчеты, выполненные для таких реальных газов, но уравнению состояния Клапейрона — Менделеева, приводят к большим погрешностям.
Уравнение состояния реального газа (1.5), учитывающее влияние сил взаимодействия между молекулами и их собственный объем, впервые было получено И. Д. Ван-дер-Ваальсом:
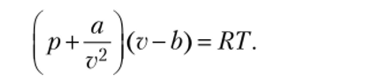
Как указывалось ранее, величина a/v2 учитывает влияние сил притяжения между молекулами на внутреннее давление газа. Величина b является собственным объемом молекул и представляет собой предельный объем, до которого можно сжать 1 кг газа.
Коэффициенты а и b для каждого газа имеют свое определенное постоянное значение. Уравнение Ван-дер-Ваальса дает качественно правильную картину поведения реального газа, однако при больших плотностях наблюдается значительное отклонение от данных, полученных опытным путем.
Уравнение Ван-дер-Ваальса было получено на основании молекулярнокинетической теории газов и не учитывало возможные ассоциации и диссоциации молекул реального газа.
Согласно теории М. П. Вукаловича и И. И. Новикова, в реальном газе происходят ассоциации отдельных молекул в комплексы, состоящие из двух, трех и более молекул, а также диссоциации этих комплексов на более простые соединения. Таким образом, реальный газ можно представить как газовую смесь, состоящую из различных комплексов. Чем ближе приближается реальный газ к линии сжижения, тем больше содержится в газовой смеси сложных комплексов.
Уравнение состояния реального газа, учитывающее ассоциацию молекул, предложенное М. П. Вукаловичем и И. И. Новиковым, записывается так:
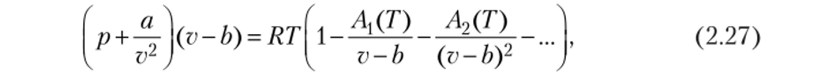
где А{(Т), А2(Т) — известные функции температуры; а и b — постоянные, имеющие тот же смысл, что и постоянные в уравнении Ван-дер-Ваальса.
Помимо уравнений состояния, предложенных Й. Д. Ван-дер-Ваальсом и М. II. Вукаловичем и И. И. Новиковым, существует большое число и других уравнений, имеющих различную степень точности.
На практике при расчетах уравнения состояния реального газа применяют редко, так как расчет по ним не только является очень трудоемким, но и не обеспечивает требуемую точность. Поэтому циклы, работающие на реальных газах, рассчитывают по соответствующим таблицам и диаграммам, построенным на основании экспериментальных данных.
При анализе фазовых равновесий и процессов фазовых переходов применяют правило фаз Гиббса, которое устанавливает связь между числом независимых переменных |/, определяющих состояние термодинамической Так для чистого вещества (п = 1).
системы, находящейся в равновесии, числом фаз г и числом компонентов системы п:


Отсюда следует, что в однофазной системе (r = 1) число независимых переменных параметров |/ = 2. Ими могут быть, например, р и Г, a v является однозначной функцией двух первых.
Для чистого вещества при наличии двух фаз (г — 2) число независимых переменных |/ = 1. Ими могут быть р или Т. Таким образом, можно сделать важный вывод: температура фазового перехода однозначно определяет собой все остальные термодинамические величины каждой из фаз: ps, г г", s', s", плотность р' и р" и т. д.[1]
Для однокомпонентной трехфазной системы (г= 3) ц/ = 0. Это означает, что в однокомпонентной системе три фазы могут находиться в равновесии лишь при вполне определенных параметрах. Для воды эта точка, называемая тройной и обозначаемая F, находится при tF = 0,01°С иpF= 0,0006 МПа.
Обычно принимают следующую классификацию точек фазового перехода:
- • точка перехода «жидкость — пар» называется точкой кипения (она же точка конденсации);
- • точка перехода «твердое тело — жидкость» называется точкой плавления (она же точка затвердевания);
- • точка перехода «твердое тело — пар» называется точкой сублимации или возгонки (она же точка десублимации).
Жидкую и твердую фазу иногда объединяют названием «конденсированная фаза». Пар, находящийся над конденсатом в состоянии равновесия системы «пар — конденсат», называется насыщенныму а его давление — давлением насыщения или упругостью насыщенного пара.
- [1] Индекс 5 при обозначении давления (р) от английского слова steam — «пар».