О процессах горения
При протекании химических реакций разрушаются связи в молекулах реагентов и образуются новые соединения, продукты. В реакциях горения происходит быстрое окисление элементов горючего, сопровождающееся выделением энергии при образовании продуктов. Основными элементами в большинстве топлив являются углерод С, водород Н и сера S. Вклад серы в производство энергии очень невелик, однако этот элемент… Читать ещё >
О процессах горения (реферат, курсовая, диплом, контрольная)
Энергию, которая необходима для работы тепловой машины, обогрева помещений, реализации потребляющих тепло технологических процессов.
(например, металлургических), часто получают с помощью процессов горения. Горение — это сложный физико-химический процесс, в результате которого химическая энергия топлива преобразуется в тепловую. Можно сказать также, что эго совокупность химических реакций, протекание которых сопровождается существенным выделением теплоты.
Схематически камеру сгорания можно изобразить в виде реактора проточного типа, в который поступают горючее и окислитель (рис. 17.1). В реакторе горючее сгорает с выделением теплоты, причем часть этой тепловой энергии затрачивается на совершение работы. Продукты сгорания вытекают из реактора.
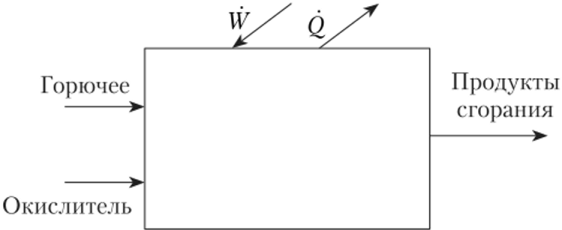
Рис. 17.1. Камера сгорания.
На практике тепловая энергия выделяется, как правило, в результате сжигания углеводородного горючего в топке. В качестве горючего могут использоваться уголь, мазут, газ и т. д.
Для анализа процессов горения необходимо обладать знаниями законов термодинамики, газовой динамики, физической и химической кинетики.
Температура горения и количество выделяемой в реакции теплоты зависят от:
- • природы горючего и окислителя;
- • их температуры;
- • их соотношений;
- • давления в камере сгорания.
Принято различать стехиометрическое и нестехиометрическое соотношения горючего и окислителя.
При стехиометрическом соотношении в реактор поступает такое количество окислителя, которое полностью взаимодействует с горючим по уравнению реакции горения. При нестехиометрическом соотношении компонентов топлива возможен избыток окислителя, тогда реагирующая смесь называется окислительной, или избыток горючего, тогда смесь называется восстановительной.
Для технических целей в качестве окислителя может использоваться как чистый кислород, так и воздух (смесь кислорода с азотом).
Для того чтобы горение началось, смесь нужно поджечь, т. е. молекулы смеси сначала нужно перевести в состояние с более высокой энергией, а уже затем начинается реакция горения, которая сопровождается образованием новых веществ и выделением теплоты. Воспламенение может произойти локально, оно сопровождается местным повышением температуры до значения, превышающего температуру воспламенения. Для этой цели можно использовать электрическую искру, раскаленную проволоку или пламя. Иногда газообразную реагирующую смесь поджигают, сжимая ее.
Протекание процесса горения после воспламенения зависит от многих факторов, в частности от типа топлива, соотношения его компонентов, конструктивных особенностей реактора и т. д. Выделяющаяся в процессе горения тепловая энергия служит для перевода других молекул смеси в реакционно-способное состояние, происходит так называемая цепная реакция.
Если значительная часть выделяющейся тепловой энергии быстро отводится от системы или выделение тепловой энергии относительно невелико, то горение происходит медленно или прекращается совсем. При нормальной организации процесса горения в промышленных установках число активированных молекул растет при воспламенении экспоненциально. При этом в некоторых условиях возможен взрыв — неконтролируемое горение, которое сопровождается очень быстрым выделением тепловой энергии.
В некоторых случаях для стабилизации горения и предотвращения взрыва в состав горючей смеси вводятся специальные добавки. В качестве такой добавки может использоваться, например, азот — инертная примесь, которая не участвует в реакциях горения, но поглощает выделяемое в других реакциях тепло.
Фронт распространения реакции горения называется фронтом пламени. Скорость горения — это скорость распространения фронта пламени. Горение, как правило, происходит в некоторой области, которую называют пламя. Температуры и скорости горения некоторых топливных композиций приведены в табл. 17.1.
Таблица 17.1
Температура и скорость горения.
Смесь. | t° °с. | Скорость горения, м/с. |
н2 + о2 | 9−11. | |
Н2 + воздух. | 1,8. | |
сн4 + о2 | 3,3−4. | |
СН4 + воздух. | 0,3−0,4. |
В некоторых случаях возможно протекание процессов горения с большой скоростью, превышающей скорость звука, — тогда говорят о детонации. При детонации образуется ударная волна, на фронте которой протекает реакция горения. При распространении волны происходят сжатие и нагрев реакционной смеси, которые инициируют реакцию горения и дальнейшее распространение детонационной волны. В смеси (Н2 + 02) скорость детонации равна приблизительно 2800 м/с.
Взрывчатые вещества по-разному реагируют на различные способы инициирования. Например, динамит горит, если его поджечь, и взрывается, если его инициировать детонатором. Скорость детонации конденсированных взрывчатых веществ больше, чем газообразных, и составляет.
5—8 км/с.
В закрытом объеме при определенных условиях горение может переходить в детонацию. Такое явление встречается в двигателях внутреннего сгорания. Когда в результате сгорания смеси происходит резкое повышение температуры и плотности, часть несгоревшей смеси может сдетонировать на участке увеличения объема.
При протекании химических реакций разрушаются связи в молекулах реагентов и образуются новые соединения, продукты. В реакциях горения происходит быстрое окисление элементов горючего, сопровождающееся выделением энергии при образовании продуктов. Основными элементами в большинстве топлив являются углерод С, водород Н и сера S. Вклад серы в производство энергии очень невелик, однако этот элемент в качестве загрязняющей примеси входит в состав многих топлив. Оксиды серы токсичны, кроме того, присутствие серы в составе топлива ускоряет процессы коррозии. Говорят, что сгорание является полным, если весь углерод окисляется до С02, весь водород — до Н20, сера — до S02 и все остальные элементы полностью окислены. Если эти условия не выполняются, сгорание является неполным.
Схематически реакцию горения можно изобразить так: горючее + окислитель —" продукты.
В соответствии с законом сохранения суммарная масса реагентов и продуктов реакции остается постоянной. Кроме того, в процессе реакции постоянной остается масса каждого химического элемента. Химические элементы при этом могут образовывать различные соединения. Число молей реагентов может отличаться от числа молей продуктов реакции.
Горючее (топливо) — вещество, которое горит. Наиболее распространенными являются углеводородные горючие, состоящие из углерода, водорода, серы и примесей. Углеводородные топлива разделяют на жидкие, твердые и газообразные.
Жидкие углеводородные топлива получают обычно из нефти с помощью процессов дистилляции и крекинга: бензин, керосин, дизельное топливо. Состав жидких топлив задается обычно в массовых долях. При проведении расчетов часто полагают, что химическая формула бензина и его свойства совпадают со свойствами октана С8Н18, а свойства дизельного топлива совпадают со свойствами додекана С12Н2Г).
Самым распространенным твердым топливом является уголь. В зависимости от места добычи состав угля может существенно меняться. Различают антрацит, бурые угли, торф и т. д. Для некоторых целей изготавливают специальные виды твердого топлива, например, ракетное топливо, которое представляет собой смесь горючего и окислителя. Можно отметить термитные составы, которые горят с выделением большого количества тепла, не образуя газовой фазы:
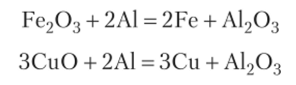
Газообразные углеводородные топлива получают из природного газа, который в нормальных условиях является смесью нескольких газов. Состав газообразных топлив задают обычно в молярных долях.
Газообразные и жидкие углеводородные топлива можно синтезировать из угля, древесины, бытовых отходов, нефтеносных песков и т. д.
Для процесса горения нужен окислитель. Обычно в качестве окислителя используется кислород. Однако чистый кислород применяется для организации процесса горения лишь в специальных случаях, когда нужно получить высокую температуру продуктов сгорания. В большинстве случаев для этой цели используется воздух. Состав воздуха, вообще говоря, зависит от местности. При проведении термодинамических расчетов используется обычно такой состав воздуха: 21% (мол.) 02 + 79% (мол.) N2.
Очевидно, что мольное отношение компонентов воздуха равно nN / п02 = = 0,79/0,21−3,76.
Таким образом, на каждый моль кислорода в воздухе приходится 3,76 моль азота. Химическую формулу воздуха можно записать как (02 + + 3,76 М2) или 02N7 52. Обычно предполагается, что азот воздуха не принимает участия в реакции горения, т. е. азот рассматривается как инертное вещество. Однако при высоких температурах возможно образование оксидов азота, которые токсичны.
Отношение воздух/горючее характеризует отношение количества воздуха в реакции к количеству горючего. Оно измеряется обычно либо как отношение масс, либо как отношение чисел молей воздуха и горючего:
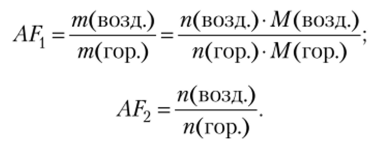
Теоретически необходимое количество воздуха (ТНКВ) — это минимальное количество воздуха, содержащее такое количество кислорода, которого достаточно для полного окисления С, Н, S в топливе. При этом продуктами сгорания являются С02, Н20, S02, N2. Свободного кислорода в составе продуктов сгорания нет.
Пример 17.1.
Определите теоретически необходимое количество воздуха для полного сжигания метана.
Решение
Запишем реакцию горения в виде.
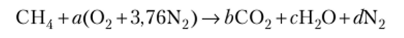
где а, Ь} с, d — стехиометрические коэффициенты.
С учетом закона сохранения масс получим: С — b = 1; Н — 2с = 4, с = 2; О — 26 + + с = 2а, а = 2; N — d = 3,76а, d = 7,52. Следовательно, уравнение реакции можно записать как.
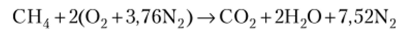
Подчеркнем, что здесь а — число молей кислорода, а не воздуха! Число молей воздуха для данного способа записи равно 2 + 7,52 = 9,52. Однако если в уравнении реакции формулу воздуха записать как 02N7 52, коэффициент а будет характеризовать число молей воздуха, 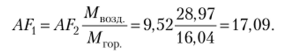
Обычно количество поступающего воздуха равно теоретически необходимому или превышает его. Количество реально поступающего воздуха часто выражают в процентах от теоретически необходимого, например 150% ТНКВ означает избыток воздуха в 50%, а 80% ТНКВ — недостаток воздуха.
Для рассмотренной в примере реакции избыток воздуха в 50% означает, что реакция имеет вид.
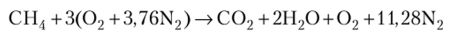
Коэффициент избытка воздуха — отношение действительного расхода воздуха к теоретически необходимому,.
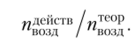
Если это отношение больше единицы, говорят, что реагенты образуют «богатую» смесь, а если меньше единицы — «бедную» смесь.
Горение является результатом последовательности сложных и быстрых реакций, поэтому образование продуктов реакции зависит от многих факторов. В частности, полнота сгорания зависит от температуры и давления в камере сгорания. Очень важным фактором является степень перемешивания горючего с воздухом. Поэтому даже если воздух поступает в камеру сгорания с избытком, т. е. больше теоретически необходимого, в процессе горения зачастую образуются продукты неполной степени окисления, например, СО. Причиной этого могут быть плохое перемешивание, малое время пребывания реагентов в реакторе, другие факторы.
Входящая в состав продуктов сгорания вода может присутствовать в виде пара или жидкости в зависимости от температуры продуктов сгорания. Поэтому принято различать «верхнюю» и «нижнюю» теплоту сгорания. «Верхняя» (большая) теплота сгорания соответствует конденсированному состоянию воды в составе продуктов, «нижняя» (меньшая) — газообразному. Очевидно, разница между «верхней» и «нижней» теплотой сгорания равна теплоте испарения воды.