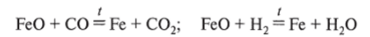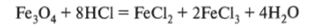Железо образует несколько оксидов, среди которых наибольшее значение имеют монооксид железа, триоксид дижелеза, тетраоксид трижелеза.
Оксид железа (Н) FeO (монооксид железа) — черное твердое порошкообразное вещество, типичный основный оксид. С водой не реагирует, так как соответствующий гидроксид нерастворим. Легко окисляется кислородом или другими окислителями (восстановитель): 
Восстанавливается восстановителями (окислитель):
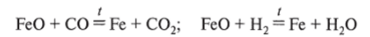
Напишите уравнения реакций взаимодействия оксида железа (II) с разбавленной серной кислотой, оксидом фосфора (У) и оксидом алюминия.
Оксид железа (Ш) Fe203 (триоксид дижелеза, полуторный оксид железа) представляет собой красно-коричневое твердое вещество, образующее различные кристаллические модификации. В зависимости от кристаллического строения пленка из этого оксида на поверхности железа и его сплавов может в разной степени защищать последнее от коррозии. В природных условиях существует в виде красного железняка (негидратированная форма) или в виде гидратированной формы — бурого железняка или лимонита. По химическим свойствам — это амфотерный оксид, у которого преобладают основные свойства, поэтому он может взаимодействовать при сплавлении с безводными щелочами или карбонатами щелочных металлов, образуя метаферриты:

Напишите уравнения реакций взаимодействия оксида железа (Ш) с серной кислотой, оксидом фосфора (), оксидом кальция. Взаимодействует ли оксид железа^III) с водой, почему?
Оксид железа (П, 1П) Fe304 (тетраоксид грижелеза, смешанный оксид железа). В природе встречается в виде минерала магнетита. Образуется при окислении железа при высокой температуре (железная окалина). Этот оксид можно представить в форме соли — метаферрита железа (Н) Fe (Fe02)2. Этот оксид хорошо проводит электрический ток. Его химические свойства многообразны. Он взаимодействует с кислотами: 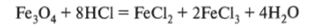
Восстанавливается под действием водорода, монооксида углерода, алюминия. Напишите уравнения этих реакций.
- 4. Теоретически возможно существование оксида железа (У1) Fe03, который должен проявлять кислотные свойства [известны соли, в которых Z?(Fe) = VI (ферраты)].
- ? Задания для самостоятельной работы
- 1. Назовите наиболее важные оксиды железа, напишите их эмпирические формулы.
- 2. Поясните, чем химические свойства монооксида железа отличаются от таковых для оксида железа (Ш).
- 3. Поясните, почему монооксид железа проявляет окислительные и восстановительные свойства. Напишите уравнения реакций, доказывающие это.
- 4. Поясните, как меняются кислотно-основные свойства оксидов железа с ростом степени окисления; ответ обоснуйте.