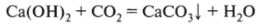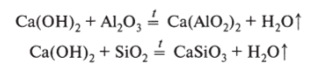Гидроксид магния Mg (OH)2 — твердое бесцветное или белое аморфное, нерастворимое в воде вещество, электролит средней силы. Основание. Взаимодействует с кислотами и разлагается при нагревании. (Напишите уравнения реакций взаимодействия гидроксида магния с соляной кислотой (2 варианта) и разложения.) Гидроксид магния получают взаимодействием соли с щелочью. Самостоятельного применения в строительстве не имеет.
Гидроксид кальция (гашеная известь) — твердое белое аморфное вещество, малорастворимое в воде, сильный электролит, щелочь. Химическая активность больше, чем у гидроксида магния, поэтому он обладает большим спектром химических свойств: он диссоциирует, реагирует с кислотными и амфотерными оксидами, кислотами, вступает в реакцию карбонизации.
Карбонизация — взаимодействие гашеной извести с углекислым газом (1 моль щелочи реагирует с 1 моль газа):
Эта реакция имеет огромное значение в строительстве: в результате ее происходит упрочнение искусственного цементного камня. Велика роль взаимодействия гашеной извести с диоксидом кремния и оксидом алюминия:
Взаимодействие гидроксида кальция с гидрокарбонатами кальция и магния применяется при водоумягчении (см. 4.4).
(Напишите уравнения взаимодействия Са (ОН)2 с углекислым газом, находящимся в большом избытке, а также с хлоридом бария, дигидрофосфатом кальция.)
Гашеная известь — важнейшее известковое вяжущее (см. гл. 5). Получают гидроксид кальция при взаимодействии оксида кальция с водой (см. 4.1.2, свойство 2).
Задания для самостоятельной работы
- 1. Поясните, кальций или магний является более активным. Обоснуйте свой ответ на основе теории строения атомов.
- 2. Поясните, почему оксид магния не реагирует с водой, а оксид кальция — реагирует.
- 3. Поясните, почему свойства гидроксида кальция более многообразны, чем таковые для гидроксида магния.
- 4. Поясните, что такое карбонизация и какова ее роль в строительстве.
- 5. Приведите обоснованные примеры, иллюстрирующие применение оксидов и гидроксидов кальция и магния в строительстве.