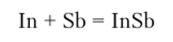Химические свойства р-металлов
Кислотных оксидов ни один из рассматриваемых металлов не имеет «в чистом виде». Самым кислотным является оксид висмута (У) Вь, 05. Однако и он не образует соответствующей висмутовой кислоты НВЮ3, поскольку висмутат-анион является неустойчивым сильным окислителем. Висмутовую кислоту можно рассматривать как гидрат оксида висмута (У) В1205* Н20. Окислительная способность В1 со степенью окисления +5… Читать ещё >
Химические свойства р-металлов (реферат, курсовая, диплом, контрольная)
Химические свойства //-металлов определяются их электронной структурой. Для элементов 13-й группы, у которых валентными являются т2пр{- электроны, характерно проявление степеней окисления +3 и в некоторых случаях +1, т. е. или полная отдача всех валентных электронов, или отрыв только одного /^-электрона. Второй случай более характерен для элементов с большим значением п, поскольку разница в энергиях /25- и яр-электронов растет с увеличением п. У таллия она достигает такой величины, что его типичная и наиболее устойчивая степень окисления равна +1.
Для элементов 14-й группы валентная конфигурация имеет вид т2пр2, и типичными для олова и свинца являются степени окисления +2 и +4. У олова более устойчива степень окисления +4, а у свинца — +2. Для единственного типичного р-металла 15-й группы — висмута — с конфигурацией валентных электронов Я52яр3 характерны степени окисления +3 и +5.
Взаимодействие с водой. Из положения металлов в ряду напряжения следует, что только алюминий должен легко взаимодействовать с водой с выделением водорода. На практике этого процесса нет, что свидетельствует о том, что в обычных условиях пет контакта алюминия с водой. Между металлом и водой всегда имеется плотная, нерастворимая, устойчивая к действию высокой температуры пленка оксида алюминия. Если создаются условия, разрушающие эту пленку или препятствующие ее образованию, начинается интенсивный процесс выделения водорода из воды:
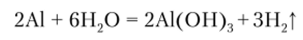
Взаимодействие с кислородом. Для всех р-металлов характерно взаимодействие с кислородом с образованием оксидов. Однако в связи с тем, что многие из образующихся оксидов образуют на поверхности металлов защитную пленку, процессы окисления компактных металлов сильно заторможены и идут медленно даже при умеренном нагревании.
Образование пероксидов для р-металлов нехарактерно. Оксиды р-металлов низших степеней окисления проявляют основные свойства, средних — амфотерные, а высших — кислотные. В качестве примеров рассмотрим оксиды, представляющие все эти группы.
Основный оксид — оксид таллия Т120, дающий в растворе щелочь — едкий таллий:
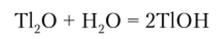
Амфотерный оксид — оксид алюминия А1203. В природе он распространен как глинозем (нестехиометрическая смесь оксидов алюминия, калия, натрия, магния и т. д.), входящий в состав бокситов. Чистый оксид алюминия может находиться в нескольких кристаллических формах: а-А1203 (корунд), у-А1203, 8-А1203, 0-Л12О3, х_А1203 и др. Все эти формы обладают разной химической активностью. Например, у-А1203 растворяется даже в разбавленных кислотах и щелочах, тогда как а-А1203 взаимодействует только с горячими концентрированными растворами кислот и щелочей, а также с расплавами щелочей при 1000 °C по следующим уравнениям: 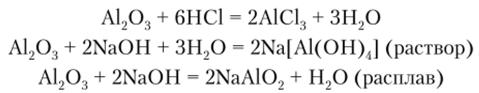
Крупные прозрачные кристаллы корунда используются как драгоценные камни. Из-за примесей корунд бывает окрашен в разные цвета: красный корунд называется рубином, синий, традиционно, — сапфиром. Согласно принятым в ювелирном деле правилам сапфиром называют кристаллический а-оксид алюминия любой окраски, кроме красной. В настоящее время кристаллы ювелирного корунда выращивают искусственно, но природные камни все равно ценятся дороже, хотя по виду и не отличаются.
Кислотных оксидов ни один из рассматриваемых металлов не имеет «в чистом виде». Самым кислотным является оксид висмута (У) Вь, 05. Однако и он не образует соответствующей висмутовой кислоты НВЮ3, поскольку висмутат-анион является неустойчивым сильным окислителем. Висмутовую кислоту можно рассматривать как гидрат оксида висмута (У) В1205* Н20. Окислительная способность В1 со степенью окисления +5 столь велика, что он окисляет даже входящий в состав этого гидрата кислород воды. В результате гидрат самораспадается с выделением молекулярного кислорода: 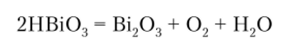
Взаимодействие с кислотами. Из особенностей химического поведения р-металлов отметим отсутствие взаимодействия алюминия с концентрированной азотной кислотой. Такая пассивация обусловлена тем, что в качестве окислителя на алюминий в этом случае действует не катион водорода (как это бывает при взаимодействии металлов с кислотами), а нитрат-анион К03. В итоге на поверхности металла образуется защитная пленка оксида алюминия: 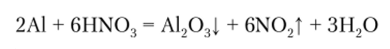
Аналогичным образом действует и концентрированная серная кислота. Эта кислота в любой концентрации пассивирует и поверхность другого р- элемента — свинца, поскольку сульфат свинца РЬ804 — очень плохо растворимая в воде соль.
Если же поверхность металла удается очистить от защитной пленки и предотвратить ее образование в ходе дальнейшего окисления, реакция с кислородом идет весьма активно. Вот как можно осуществить этот процесс для алюминия. Первичную оксидную пленку убирают абразивом оксида ртути, который, придя в соприкосновение с металлическим алюминием, восстанавливается до металлической ртути:
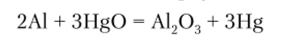
Металлическая ртуть растворяет металлический алюминий, образуя амальгаму, и на поверхности амальгамы алюминий вступает во взаимодействие с кислородом воздуха, но образующийся при этом оксид алюминия не соприкасается с поверхностью металла и не образует плотно прилегающую к нему защитную пленку (см. видео на сайте http://www.youtube.com/ watch? v=hcZbqбogodU).
Взаимодействие со щелочами. Практически все оксиды р-металлов являются амфотерными. Со щелочами взаимодействуют и сами металлы А1, ва, Бп, РЬ, В1 с образованием соответствующих алюминатов, галлатов, станнатов, плюмбатов и висмутатов. В некоторых случаях это взаимодействие идет в растворах при сравнительно мягких условиях (алюминаты), в некоторых — только в жестких условиях сплавления и спекания в окислительной среде (плюмбаты и висмутаты).
В качестве примера рассмотрим процесс растворения олова в щелочи, который нашел важное практическое применение. Широкое использование олова для производства белой жести ставит проблему возврата металла при переработке оловосодержащего металлолома. Растворы кислот для снятия олова не нашли промышленного применения из-за растворения в них стальной основы белой жести и большого расхода кислоты. В щелочных растворах железо не растворяется, что позволяет применять аппаратуру из обычной стали. В качестве растворителя олова применяют раствор NaOH. Процесс интенсивно протекает в присутствии кислорода с образованием гексагидроксостанната натрия:
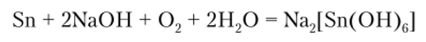
Взаимодействие с водородом, галогенами и другими неметаллами. Непосредственно с водородом p-металлы не реагируют, но косвенным путем можно получить их ковалентные гидриды в виде аморфных твердых веществ (для алюминия, галлия, индия) или неустойчивых газов (для олова, свинца и висмута). Из солеобразных гидридов наиболее известен литийалюминий гидрид LiAlH4, быстродействующий сильный и селективный восстановитель, являющийся комплексным соединением Li[AlHJ.
С галогенами большинство p-металлов реагируют при нормальных условиях с образованием соответствующих галогенидов. Среди соединений p-металлов с другими p-элементами особое значение имеют соединения рметаллов 13-й группы с неметаллами 15-й группы. Эти соединения являются основой для получения полупроводниковых материалов. Например, простым смешением порошков индия и сурьмы получается полупроводниковый материал ан гимонид индия: