Титан, цирконий, гафний

А — титан; 6 — цирконий; в — гафний Химическая активность в подгруппе увеличивается снизу вверх, титан является по положению самым активным элементом. Особенностью этих металлов является то, что их активность сильно зависит от температуры. При обычных температурах из-за защитных оксидных пленок (которые разрушаются при нагревании) они устойчивы к большинству агрессивных сред. С повышением… Читать ещё >
Титан, цирконий, гафний (реферат, курсовая, диплом, контрольная)
Распространение в природе и получение металлов. Эти металлы относятся к рассеянным. Так, содержание титана в обычных почвах может составлять до 0,6% (мае.). Однако существуют и минералы, имеющие промышленное значение. Для получения титана используются минералы: ТЮ2 — рутил, анатаз, брукит; СаТЮ3 — перовскит, FeTi03 — ильменит; для получения циркония: Zr02 — бадделит, ZrSi04 — циркон.
Получение металлов в промышленности можно представить схемой на примере титана:

Затем в стальных аппаратах в атмосфере аргона титан восстанавливают из тетрахлорида магнием:
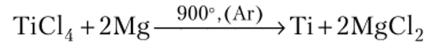
Дальнейшая переплавка губчатого титана производится в вакууме или атмосфере аргона.
Цирконий и гафний еще более распылены. Цирконий — не редкий, но рассеянный элемент. В земной коре его больше, чем меди, олова или цинка, однако распыленность циркония настолько велика, что его применение долгое время оставалось ограниченным из-за очень высокой стоимости производства.
Гафний самостоятельных минералов не образует и всегда сопутствует цирконию.
Ежегодно все страны мира, вместе взятые, добывают около 50 т гафния. Его получают в качестве побочного продукта при добыче диоксида циркония.
Металлические цирконий и гафний получают аналогичным способом — восстановлением тетрахлоридов этих металлов расплавленным магнием в инертной атмосфере.
Физические и химические свойства. Титан, цирконий и гафний представляют собой тугоплавкие серебристо-белые металлы, обладающие высокой пластичностью, ковкостью в холодном состоянии, износоустойчивостью. Высокие температуры плавления титана и его аналогов свидетельствуют о металло-ковалентном (а не чисто металлическом) характере связей в кристаллах. При этом температура плавления в ряду Ti—"Zr—"Hf возрастает, в противоположность закономерности, наблюдающейся в главной подгруппе (в ряду С—>Si->Ge->Sn^Pb).
Внешний вид металлических титана, циркония и гафния представлен на рис. 10.1.

Рис. 10.1. Внешний вид металлов IVB-подгруппы:
а — титан; 6 — цирконий; в — гафний Химическая активность в подгруппе увеличивается снизу вверх, титан является по положению самым активным элементом. Особенностью этих металлов является то, что их активность сильно зависит от температуры. При обычных температурах из-за защитных оксидных пленок (которые разрушаются при нагревании) они устойчивы к большинству агрессивных сред. С повышением температуры активность металлов возрастает, и у титана при температуре его плавления является одной из самых высоких среди металлов.
При нагревании они реагируют практически со всеми простыми веществами:

Отношение к НГ. С газообразными галогеноводородами эти металлы образуют соединения со степенью окисления +4:
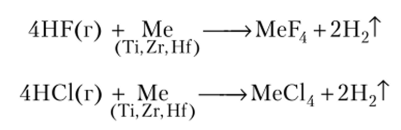
С водными растворами образуются соединения в степени окисления +3:
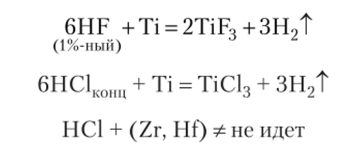
Отношение к воде, щелочам, кислородсодержащим кислотам. Вода даже на самый активный элемент из этих металлов, Ti, не действует (из-за защитной пленки). В растворах щелочей Ti растворяется, так как щелочь разрушает оксидную пленку и дальше титан реагирует с водой. Суммарное уравнение реакции:
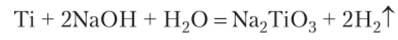
Цирконий реагирует с щелочами лишь при сплавлении.
Действие кислородсодержащих кислот зависит от состояния поверхности металла. На идеально отполированный титан кислоты не действуют. Но достаточно царапины для нарушения поверхности и возможности реакции:

Царская водка растворяет все три металла:

Разбавленная серная кислота на холоду на титан не действует (предохраняет защитная пленка). При нагревании защитная пленка разрушается, и титан растворяется:
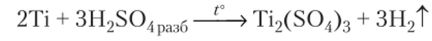
Действует на него и концентрированная (50%-ная) серная кислота при любой температуре:
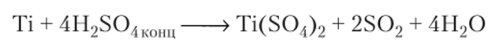
На Zr и Ш серная кислота (H2S04) не действует.
Rf (резерфордий) — химический аналог гафния. Реагирует с хлором, образует в растворе анионные комплексы. Другие химические свойства не изучены.
Свойства соединений элементов IVB-подгруппы. Из соединений титана, циркония и гафния устойчивы только оксиды Э (1У). Оксиды и гидроксиды этих элементов — амфотерны, но с преобладанием основных свойств, усиливающихся от ТЮ2 к НЮ2:
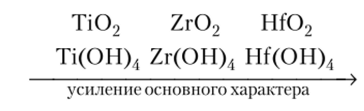
Оксиды титана, циркония, гафния — инертные, нерастворимые вещества, с разбавленными кислотами не реагируют. Очень медленно идет растворение в кипящей плавиковой и концентрированной серной кислотах. Со щелочами и основными оксидами взаимодействуют при сплавлении:
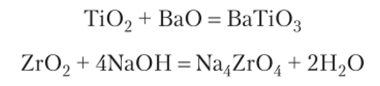
Гидроксиды получают действием щелочей на соли IV-валентных металлов.
Амфотерный гидроксид титана (1У) может выступать как ортоили метатитановая кислота: 
Гидроксиды легко растворяются в сильных кислотах, а в щелочах — только при сплавлении.
У титана имеется целый ряд надкислот, например:

Галогениды титана, циркония, гафния в разной степени окисления обладают различными свойствами. Соединения формы МеГ2 представляют собой соли, обладающие ионной связью (как правило — твердые вещества). Для них характерны восстановительные свойства, которые усиливаются в ряду TiT2—"ZiT2—>HfT2. В связи с этим галогениды (П) титана, циркония, гафния крайне неустойчивы.
Гидролиз хлорида титана (П) (соли с ионной связью) идет преимущественно по первой ступени:
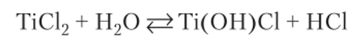
МеГ3, хотя и являются солями, способны при растворении частично подвергаться гидролизу. Хлорид титана (Ш) диспропорционирует:
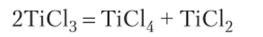
МеГ4 отличаются от ионных галогенидов, т. е. их нельзя рассматривать как соли галогеноводородных кислот. Это ковалентные соединения, неэлектролиты. При растворении в воде МеГ4 гидролизуются с образованием двух кислот:
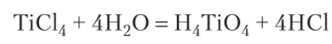
При высокой температуре гидролиз идет с образованием оксида:
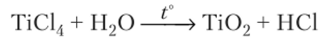
Гидролиз аналогичных соединений циркония проходит менее интенсивно, а гидролиз соединений гафния идет лишь частично.
Галогениды IV-валентных титана, циркония и гафния способны к образованию различных комплексных соединений: комплексных кислот Н2[МеГ6] и солей Мех[МеГГ)]:
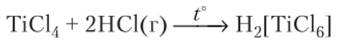
Достаточно изучены соединения титана, циркония, гафния с водородом, азотом, углеродом, бором, фосфором и др. Полученные гидриды, нитриды, карбиды и другие соединения — это твердые металлоподобные вещества, частично относящиеся к соединениям переменного состава.
Применение. Ценные свойства титана (большая механическая прочность при малой плотности, термическая и коррозионная устойчивость) позволяют предполагать, что он станет металлом будущего. Титан входит в состав легких и прочных сплавов для авиационной и ракетной техники.
В микроэлектронике активные диэлектрики на основе оксидов ТЮ2, Zr02, НЮ2 применяются при изготовлении МДП-структур, титановые пленки используют в качестве подслоя на диэлектрических подложках.
Нитрид титана TiN используют для шлифовки драгоценных камней вместо порошкообразного алмаза.
Цирконий и сплавы на его основе — важнейшие конструкционные материалы ядерпых реакторов, благодаря жаропрочности и кислотоустойчивое™ они применяются в турбостроении и в оборонной технике.
Гафний способен хорошо захватывать нейтроны, из него делают стержни для регулирования работы ядерных реакторов. Основные области применения металлического гафния — производство сплавов для аэрокосмической техники, атомная промышленность, специальная оптика.
Токсичность элементов. Титан нс является токсичным для человеческого организма в любых дозах. Мелкодисперсный цирконий вызывает раздражение при попадании на кожу, при попадании в глаза может потребоваться медицинская помощь. ПДК циркония в рабочих помещениях составляет 5 мг/м3, а краткосрочное содержание — не более 10 мг/м3. О токсикологических свойствах гафния известно немного.