Марганец, технеций, рений

Рений — типичный тугоплавкий металл, однако по ряду свойств он значительно отличается от других тугоплавких металлов, таких как молибден или вольфрам и в некоторой степени приближается к благородным металлам типа платины, осмия, иридия. Он устойчивее вольфрама к окислению, и лампы, изготовленные с рениевой нитью, являются практически «вечными» (срок службы до 100 лет). Он пластичен и жаростоек… Читать ещё >
Марганец, технеций, рений (реферат, курсовая, диплом, контрольная)
Распространение в природе и получение металлов. Марганец в природе встречается в виде минералов пиролюзита Мп02, гаусманита Мп304, браунита Мп203, марганцового блеска MnS.
В промышленности его получают электролизом раствора сульфата марганца (П) или восстановлением из оксидов кремнием в электрических почах:
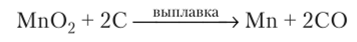
В лаборатории марганец получают, используя метод алюмотермии:
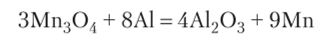
Технеций получают посредством ядерной реакции, например:
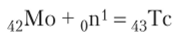
В настоящее время практически весь используемый технеций получают при переработке отработанного ядерного топлива, в котором он образуется из урана в результате деления ядер.
Раньше считалось, что в природе технеция вообще нс существует, однако более поздние исследования показали, что он может образовываться в нанограммовых количествах из урана при спонтанном делении (как и в реакторе, но в природе такое деление происходит значительно реже). Кроме того, технеций, скорее всего, образовывался и в так называемых природных ядерных реакторах, которые существовали в местах залежей урана.
Рений в природе в свободном состоянии встречается в метеоритном железе, найденном в различных местах Земли. Он относится к очень рассеянным элементам (содержание в земной коре равно 1,0 • 10~7% (мае.)). Минералы молибденит MoS2, колумбит (Fe, Mn) Nb206, танталит (Fe, Mn) Ta206 содержат 10 3—10 4% (мае.) рения и являются основным сырьем для его производства.
Рений получают восстановлением перренага калия KRe04, а в компактное состояние переводят методом спекания.
Получение рения, например, из молибденита можно представить схемой:
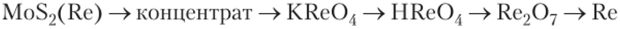
Единственное в мире экономически выгодное месторождение Re обнаружено в 1992 г. в России на Южно-Курильских островах (остров Итуруп) на вулкане Кудрявый[1]. Рений там находится в виде минерала ренит (курилит) ReS2, со структурой, аналогичной молибдениту MoS2.
Мировое производство рения в 2012 г. составило 54,9 т.
Физические и химические свойства. Металлические свойства элементов ослабевают сверху вниз по подгруппе, что обусловлено значительным увеличением заряда ядра (25Mn, 43ТС, 75Re) и очень малым изменением радиуса атома (соответственно 1,30, 1,36, 1,37 А).
Марганец — серебристо-белый твердый хрупкий металл. Благодаря способности к пассивации он довольно коррозионно-устойчив и используется преимущественно в производстве легированных сталей (до 15% Мл), обладающих высокими твердостью и прочностью.
При нагревании марганец энергично реагирует с галогенами, кислородом, серой. При температуре выше 1200 °C в атмосфере азота он сгорает с образованием нитрида Mn3N2. Он также реагирует с бором, кремнием и углеродом:

Отношение к кислотам и щелочам. В ряду напряжений марганец находится между Mg и Zn, в тонкодисперсном состоянии при нагревании может вытеснять водород из воды и растворов кислот (HCl, H2S04) с образованием иона Мп2+. Например:
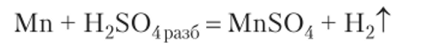
Холодные концентрированные H2S04 и HN03 пассивируют марганец, но при нагревании идут реакции:
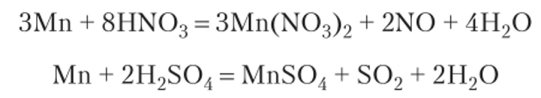
Рений — типичный тугоплавкий металл, однако по ряду свойств он значительно отличается от других тугоплавких металлов, таких как молибден или вольфрам и в некоторой степени приближается к благородным металлам типа платины, осмия, иридия. Он устойчивее вольфрама к окислению, и лампы, изготовленные с рениевой нитью, являются практически «вечными» (срок службы до 100 лет). Он пластичен и жаростоек, сохраняет свою пластичность от температуры абсолютного нуля до своей температуры плавления (3175°С).
В химическом отношении он инертен и взаимодействует с кислородом и галогенами при температурах выше 300—600°С:
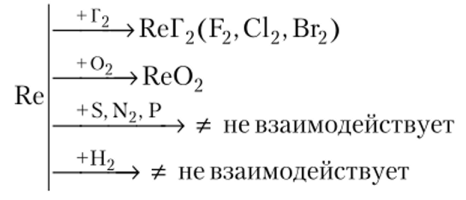
На рений разбавленные соляная, плавиковая и серная кислоты не действуют. Концентрированная азотная кислота и пероксид водорода Н202 окисляют его до рениевой кислоты HRe04:
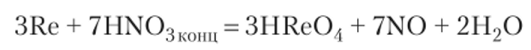
Щелочи в присутствии окислителей переводят рений в соли рениевой кислоты — перренаты:
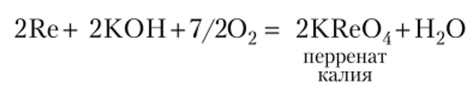
Технеций подобно рению окисляется концентрированной азотной кислотой (лучше в смеси HN03 + HCl) и очень сильными окислителями (НСЮ4, КСЮ3):
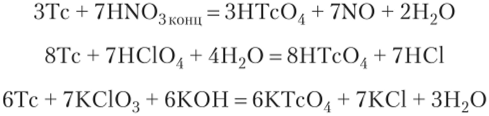
В щелочах технеций не растворяется.
Соединения элементов VIIB-подгруппы. С кислородом марганец образует оксиды (им соответствуют гидроксиды), химический характер которых меняется от основного до сильно кислотного (табл. 13.2).
Таблица 13.2
Химический характер оксидов марганца.
Вещества и свойства. | Степень окисления. | ||||
+2. | +3. | +4. | +6. | +7. | |
Оксид. | МпО. | Мп203 | Мп02 | (Мп03). | Мп207 |
Гидроксид. | Мп (ОН)2 | Мп (ОН)3 | Мп (ОН)4 = = Н4Мп04 — - Н20 =. = Н2Мп03 | (Н2Мп04). | НМп04 |
Кислотность. | Основный. | Слабоосновный. | Амфотерный. | Слабокислотный. | Сильнокислотный. |
Кислоты. | ; | Марганцовати; стая. | Марганцовистая. | Марганцовая. | |
Соли. | ; | Манганиты. | Манганаты. | Перманганаты. | |
Таков же характер изменения свойств для Re (для Тс и Re наиболее устойчива степень окисления +7). Восстановлением Re207 оксидом серы (1У) S02 получают последовательно Re03, Re308 (промежуточный оксидом, отвечающий составу 2Re03Re02) и, наконец, Re02.
Соединения марганца{). Оксид марганца (П) МпО представляет собой зеленоватый порошок, практически не растворимый в воде. Он может быть получен нагреванием пиролюзита в токе Н2:
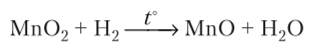
или разложением карбоната, гидроксида или оксалата двухвалентного марганца в токе инертного газа:
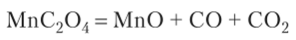
При растворении в кислотах МпО образуются соли двухвалентного марганца. Хлорид марганца (Н) можно получить и из пиролюзита:
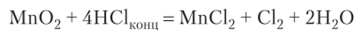
При действии на соли Мп (П) щелочью получают гидроксид Мп (ОН)2:
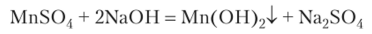
Свежеосажденный Мп (ОН)2 представляет собой белый рыхлый осадок, быстро буреющий на воздухе вследствие окисления:
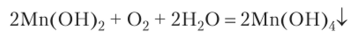
В присутствии солей аммония гидроксид марганца (1У) не выпадает в осадок вследствие обратимости процесса.
При действии на ион Мп2+ сульфид-иона образуется характерный осадок MnS телесного (розоватого) цвета:
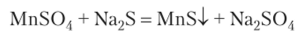
Мп2+ — слабый восстановитель. Сильные окислители, например NaBi03, Pb02, (NH4)2S208, в кислой среде переводят Мп+2 в марганцовую кислоту НМп04. В нейтральной и щелочной среде образуется Мп02:
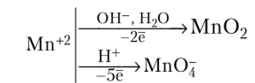
Примеры окисления Мп2+:
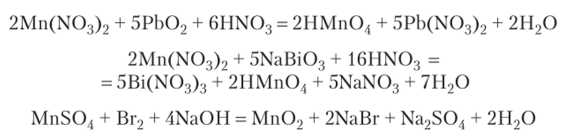
Соединения марганца (Ш). В природе соединения марганца (Ш) встречаются в виде браунита Мп203. В лабораторных условиях его получают прокаливанием пиролюзита на воздухе: 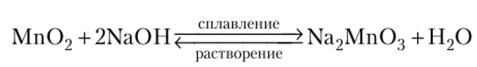
В концентрированных серной и соляной кислотах при нагревании Мп203 дает соли Мп (Н), а на холоду — соли Мп (Ш).
Гидроксид марганца (Ш) Мп (ОН)3 — слабое основание, плохо растворимое в воде.
Соединения трехвалентного марганца получаются растворением на холоду в кислотах оксидов Мп203, Мп304 и Мп02 и существуют только при низких температурах. При обычной температуре они разлагаются, а в водных растворах полностью гидролизуются и окисляются до Mn (IV).
Соединения маргаица{). Мп02 — наиболее устойчивое соединение марганца. В природе он встречается в виде минерала пиролюзита. В лабораторных условиях его можно получить нагреванием на воздухе как высших, так и низших оксидов до 350 °C. Выше этой температуры он восстанавливается до Мп304.
Так как гидроксид Мп (ОН)4 амфотерен, то и соединения его, естественно, делятся на две группы.
К первой группе относятся соли Мп4+. Они еще менее устойчивы, чем соли трехвалентного марганца. Наиболее устойчивыми являются дигидроарсенат марганца Mn (H2As04)3 и дисульфид MnS2. Более устойчивы комплексные соли типа Me2[MnF6].
Ко второй группе относятся соли орто- и метамаргапцоватистых кислот Н4Мп04 и Н2Мп03 (кислоты в свободном состоянии не выделены). Соли этих кислот называются манганитами.
В водных растворах манганиты не существуют. При растворении в воде они гидролизуются с образованием Мп02.
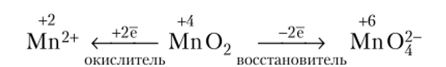
Оксид марганца (П, III) Мп304 (Мп02 Мп203) можно представить себе как соль марганца (И) и марганцоватистой кислоты Мп2Мп04.
Мп02 обладает окислительно-восстановительной двойственностью, может быть и окислителем, и восстановителем: 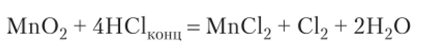
Примеры:
Мп02 — окислитель, применяется для лабораторного получения хлора:
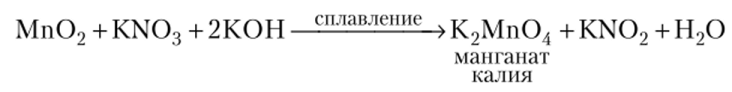
Mn02 — восстановитель, при сплавлении с щелочью в присутствии окислителя образует соль марганца (У1):
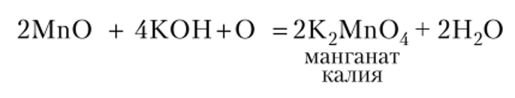
Re02 — черные, нерастворимые в воде кристаллы, получают косвенным путем Все соединения рения низших валентностей в водных растворах окисляются и переходят в производные семивалентного рения.
Соединения марганца (). Оксид марганца (У1) МпОэ и гидроксид, называемый марганцовистой кислотой, Н2Мп04 в свободном состоянии не выделены вследствие их неустойчивости.
Манганаты — соли марганцовистой кислоты Н2Мп04 получаются сплавлением металлического марганца, оксидов или его солей со щелочами в присутствии кислорода воздуха или других окислителей:
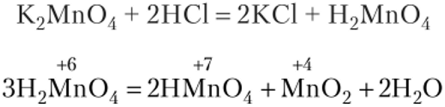
При действии на манганаты разбавленных кислот получается неустойчивая марганцовистая кислота, которая тотчас распадается:
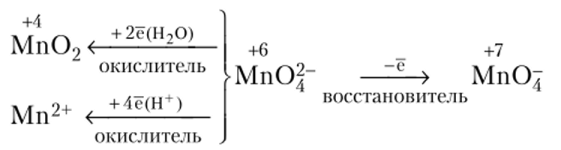
Ион Мп04" обладает окислительно-восстановительной двойственностью:
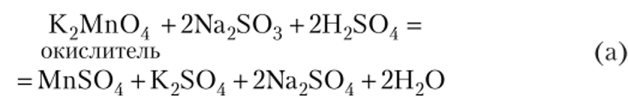
Он может участвовать в процессах восстановления (а), окисления (б) и в реакциях диспропорционирования (в): 
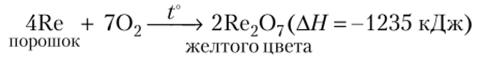
Соединения металлов в степени окисления^VII). Для марганца, технеция и рения оксиды в высшей степени окисления отвечают формуле Э2О7.
Оксид Re207 — наиболее характерный для рения. Его получают прокаливанием порошкообразного рения в атмосфере кислорода:
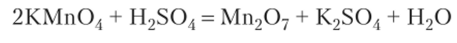
Оксид Тс207 получают аналогично, в атмосфере кислорода при 500 °C он летуч.
Оксид Мп207 — зеленовато-черная маслянистая жидкость (устойчив ниже 0°С) Получают его косвенным путем, действием 90%-ной серной кислоты на концентрированный раствор КМп04:
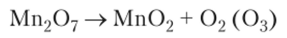
Мп207 — сильный окислитель, мгновенно разлагается при положительных температурах:
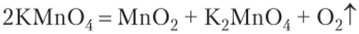
При растворении оксидов Э207 в воде образуются кислоты: фиолетово-красная НМп04 — марганцовая (соли перманганаты), бесцветные НТс04 и HRe04 — технециевая и рениевая (соли пертехнаты и перренаты). Это сильные кислоты, и по степени диссоциации подобны соляной и азотной.
Марганцовая кислота в водном растворе существует только в небольших концентрациях, не выше 20%. При большей концентрации она разлагается, выделяя Мп02, который при таком способе получения обладает особенно сильными каталитическими свойствами.
Перманганаты, соли марганцовой кислоты, получают электролизом растворов манганатов. Наибольшее применение имеет перманганат калия.
При нагревании перренаты устойчивы, а перманганаты разлагаются:
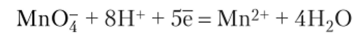
Окисление перманганатом протекает различно, в зависимости от среды, в которой ведется окислительно-восстановительный процесс. В кислой среде.
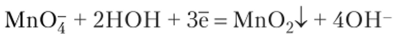
В нейтральной среде.
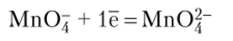
В сильно щелочной среде.
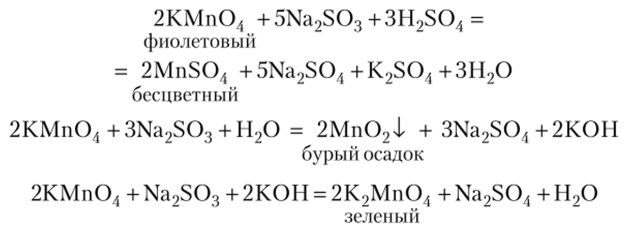
Примеры восстановления КМп04 в различных средах:
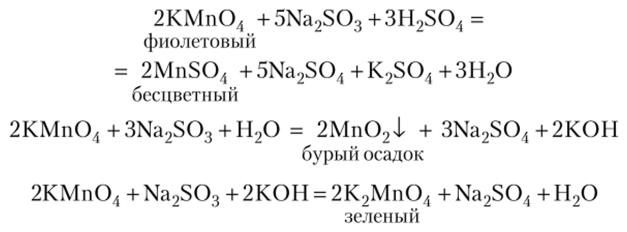
Применение. Перманганат калия широко применяют в аналитической химии, в медицине.
Марганец — раскислитель и легирующий металл в производстве стали. Он придает сталям твердость, прочность, износоустойчивость. Он входит в состав многих сплавов (манганин, бронза, латунь).
Пертехнаты (соли НТс04) — эффективные ингибиторы коррозии стали в воде, даже при 250 °C. Катализаторы в реакциях органического синтеза.
Рений относится к перспективным металлам, обладает химической инертностью, хорошими механическими свойствами и высокой температурой плавления. Его применяют в сплавах с платиной для термопар: Pt — Pt-Re, W — Re.
Рений также используют для изготовления нитей электроламп и в качестве катализатора.
Токсичность элементов. В природные воды марганец поступает в результате выщелачивания железомарганцевых руд и других минералов почвогрунтов. Значительное количество поступает в процессе разложения остатков водных животных и растительных организмов. Содержание марганца в воде родников подвержено сезонным колебаниям. ПДК марганца в питьевой воде — 0,1 мг/дм. Повышенное содержание марганца в питьевой воде достаточно вредно для здоровья человека. Он считается одним из наиболее часто встречающихся токсических элементов в составе родниковой воды и при превышении ПДК может вызывать множество нежелательных последствий для здоровья. Марганец накапливается в организме человека и его почти невозможно вывести. Он проникает в канальцы нервных клеток и тем самым препятствует прохождению нервных импульсов. Вследствие этого у человека появляются утомляемость, сонливость, снижается работоспособность, часто возникает головокружение. Отравление марганцем очень сложно диагностировать. Симптомы при отравлении марганцем присущи многим заболеваниям. В результате постоянного употребления питьевой воды, в которой превышено содержание марганца, может начаться хроническое отравление этим металлом. Отравление имеет либо неврологическую, либо легочную форму. В случае неврологической формы отравления у пациента наблюдается полное безразличие к происходящим вокруг событиям, сонливость, потеря аппетита, головокружения, сильные головные боли.
- [1] URL: http://www.cmmarkct.ru/