Характер изменения свойств s-и p-элементов в периодах
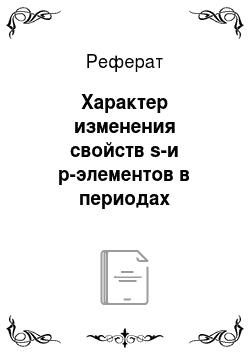
Пунктиром соединены точки p-элементов четвертого периода, перенесенные на 10 единиц влеВо. Хорошо в идно различие ropQ для пар Mg, AI и Са, Ga ван полностью заполненной оболочкой, образовавшейся у атома Ne. Увеличение заряда ядра на единицу при переходе к Mg и появление второго 5-электрона приводит к заметному уменьшению горб. так как 5-электроны за счет внутренних максимумов хорошо «чувствуют… Читать ещё >
Характер изменения свойств s-и p-элементов в периодах (реферат, курсовая, диплом, контрольная)
Итак, Вы перечли гл. 3, вспомнили, что гор5 пропорционально п2 и обратно пропорционально Z^, a I^n2/Z2^y и мы можем приступить к обсуждению.
Наша задача будет заключаться в том, чтобы увидеть связь между изменением квантовых чисел валентных электронов атомов и изменением химических свойств соответствующих элементов.
Не вычисляя Zэф, мы будем говорить лишь об основных тенденциях его изменений по отношению к определенным электронам, положив в основу рассмотрения заряд ядра или, что-то же самое, атомный номер элемента. Прежде всего рассмотрим, как меняются размеры атомов.
На рис. 29.1 показана зависимость горб от атомного номера, т. е. от заряда ядра для элементов третьего и четвертого периодов.
Орбитальный радиус атома Na много больше, чем предшествующего Ne (г0рб = 0,035 нм), так как единственный s-электрон хорошо экраниро;
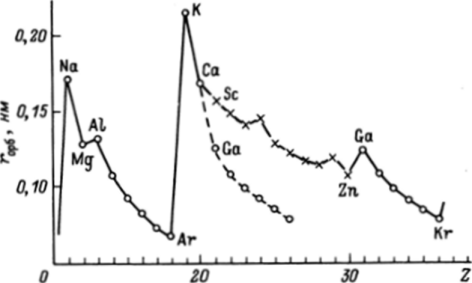
Рис. 29.1. Зависимость орбитального радиуса атомов элементов третьего и четвертого периодов от заряда ядра.
Пунктиром соединены точки p-элементов четвертого периода, перенесенные на 10 единиц влеВо. Хорошо в идно различие ropQ для пар Mg, AI и Са, Ga ван полностью заполненной оболочкой, образовавшейся у атома Ne. Увеличение заряда ядра на единицу при переходе к Mg и появление второго 5-электрона приводит к заметному уменьшению горб. так как 5-электроны за счет внутренних максимумов хорошо «чувствуют» увеличение заряда. У элемента cZ = 13 появляется первый Зр-электрон. Внутренний максимум р-электронов дальше от ядра, чем у 5-электронов, кроме того, 35-электроны заметно экранируют Зр-электроны, в результате атома А1 даже больше, чем Mg. Дальнейшее увеличение заряда ядра и увеличение числа р-электронов сопровождается увеличением и уменьшением горб вплоть до Аг.
Как же изменения игорб сказываются на химических свойствах? Прежде всего, увеличение Z^ при постоянном п ведет к увеличению потенциала ионизации, а это, в свою очередь, к увеличению электроотрицательности.
Увеличение / при одновременном увеличении числа валентных электронов, все более заполняющих зону проводимости, приводит к ослаблению металлических и усилению неметаллических свойств простых веществ элементов по мере увеличения их атомного номера и уменьшения ''орб в периоде. В этом же направлении увеличение электроотрицательности сопровождается ослаблением восстановительных и усилением окислительных свойств.
Отсюда следует, «по произвольно выбранный элемент при образовании бинарных соединений будет выступать в роли окислителя по отношению к соседям, расположенным слева, и в роли восстановителя по отношению к соседям справа. Например, взаимодействие фосфора с магнием и серой приводит к образованию фосфида магния и сульфида фосфора: 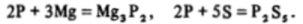
В соответствии со степенями окисления фосфора в этих соединениях идет их гидролиз, взаимодействие с неокисляющими кислотами или основаниями:
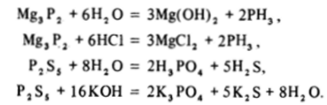
Совершенно аналогично ведет себя бор при образовании соединений с литием и азотом или теллур при взаимодействии с сурьмой и иодом.
Чем дальше друг от друга расположены элементы в периоде (т. е. чем больше разность их электроотрицательностей и гсирб), тем ближе их бинарные соединения по своим свойствам к солям. Например, арсенид галлия, подобно германию, имеет алмаэоподобную решетку с ковалентными связями, тогда как бромид калия — типичная соль с ионным характером связи в кристалле.
С этих же позиций можно проследить в зависимости otZ при постоянном п изменение свойств и более сложных соединений, например ги дрок соп роизводных.
Рассмотрим фрагмент Э-О-Н. Если электроотрицательности Н и Э близки, то полярности связей Э—О и О-Н примерно одинаковы, а значит, диссоциация ЭОН в водном растворе будет равновероятно протекать как с образованием протона (гидроксония) по типу ЭОН = ЭСГ + + PP, так и с образованием иона гидроксида по типу ЭОН = Э* + ОН" (см. разд. 16.2).
Если электроотрицательность элемента Э существенно меньше, чем электроотрицательность водорода (такие элементы расположены в начале периода), то полярность связи 3—0 будет больше, чем связи О—Н, и диссоциация будет идти с образованием гидроксид-иона, в противном случае диссоциация будет идти с образованием протона (иона гидроксония), как это видно на примере пары NaOH и СЮН.
Таким образом, увеличение электроотрицательности элементов при движении по периоду слева направо приводит к росту кислотных свойств гидроксидов и закономерному переходу от оснований к кислотам.
Вернемся к рис. 29.1. Появление 4s-электрона приводит к резкому увеличению размера атома калия по сравнению с атомом Аг. Далее гор (5 уменьшается и общая тенденция его изменения подобна той, которая была в третьем периоде. Существенное различие в том (см. разд. 3.5), что в четвертом периоде происходит заполнение 3</-оболочки. Вслед за кальцием, от Sc до Zn, идет первый переходный ряд (первая вставная декада), и заряды ядер атомов кальция и галлия отличаются не на единицу, как в случае Mg-Al, а на 11 единиц. Для того чтобы подчеркнуть возникающие при этом изменения, кривая rop6(Ga-Кг) на рисунке перенесена на 10 единиц влево (пунктирная кривая). Хорошо видно, что появление внутренней 3dоболочки приводит к значительному уменьшению размеров атомов и горб Ga оказывается существенно меньше (а не больше, как можно было бы предполагать по аналогии с Mg-Al), чем rop6 С3— Уменьшение горб, увеличение / и электроотрицательности — все это приводит к усилению неметаллических свойств 4р-элементов по сравнению с тем, что мото бы быть при отсутствии 3</-оболочки. В то же время основная тенденция изменения горб при переходе от Ga к Кг сохраняется такой же, как и при переходе от А1 к Аг.
Таким образом, при увеличении заряда ядра (атомного номера) в пределах одного периода всегда возрастает уменьшается г0рб и происходит переход от металлов к неметаллам. Те изменения, которые возникают в результате появления d— или /оболочек, проявляются в большей степени на изменении свойств элементов в группах, когда число валентных электронов и конфигурация внешней электронной оболочки сохраняются, a меняется в соответствии с изменением главного квантового числа п.