Химия водных растворов

Схема восстановительных потенциалов скандия в кислой (pH = 0) и щелочной (pH = 14) средах приведена вместе с аналогичными схемами для остальных переходных элементов первого ряда в Приложении 1. Схема для скандия очень проста. Она включает кроме металла лишь одну степень окисления — Sc (IIl), представленную в кислой среде гидратированным ионом Sc3* (водн) и в щелочной — твердым гидратированным… Читать ещё >
Химия водных растворов (реферат, курсовая, диплом, контрольная)
Все переходные металлы первого ряда с большим или меньшим трудом можно растворить в кислотах и получить в результате кислый водный раствор соли. Какие конкретно частицы будут присутствовать в таком растворе? Что будет происходить с ними в зависимости от изменения pH раствора? Каковы их окислительно-восстановительные свойства? Существуют ли у них какие-то специфические химические свойства? Какие соединения можно выделить из раствора? На все эти вопросы мы попытаемся ответить в данном разделе, а в некоторых счастливых случаях попробуем ответить и на вопрос — почему.
Начнем по порядку — со сканди я. Металл легко растворяется в разбавленных кислотах, образуя катион Sc3* (водн). Для наших целей лучше брать кислоту, анионы которой не склонны входить в состав комплексных соединений в качестве лигандов, а именно: НС104, HPF6, HBF4. В таких средах Sc3* (водн), так же как и остальные катионы переходных элементов первого ряда с зарядом от +1 до +3, при достаточно низких значениях pH, когда гидролиз еще незаметен, представляет собой лабильные аквакомплексы с внутренней сферой М (Н20)" * октаэдрического строения, окруженные диффузной оболочкой из молекулы воды. Число молекул воды во внешней сфере аквакомплексов зависит от их концентрации, а также от присутствия других ионов. Образование акватированного иона Sc3* (вода) из свободного иона Sc3* (г) энергетически очень выгодно (Д//?"др * -5300 кДж/моль), поскольку при высоком заряде ион Sc3* невелик (г^ «0,083 нм).
По величине отношения заряда к радиусу ион Sc3* занимает промежуточное положение между Mg2* и А1, поэтому можно ожидать, что он будет проявлять склонность к гидролизу, правда в меньшей степени, чем алюминий. Гидролиз ионов скандия довольно сложен, он сопровождается образованием полимеров с двойными гидроксидными мостиками между ионами скандия.
И, наконец, в щелочной среде осаждается гидратированный оксид Sc203 • лН20. При упаривании сильнощелочных растворов (С^аон > > 8 моль/л) кристаллизуется соль Na3[Sc (OH)6] -2Н20. При меньшей щелочности анион (Sc (OH)6]3" гидролизуется, последовательно присоединяя протоны и переходя, в конце концов, в гидратированный оксид.
Гидроксид скандия определенного состава Sc (OH)3, как и большинство гидроксидов переходных элементов первого ряда, по-видимому, не существует.
Таким образом, оксид скандия имеет выраженный основный характер, но он все же слабо амфотерен, т. е. действительно скандий занимает промежуточное положение между магнием и алюминием.
Схема восстановительных потенциалов скандия в кислой (pH = 0) и щелочной (pH = 14) средах приведена вместе с аналогичными схемами для остальных переходных элементов первого ряда в Приложении 1. Схема для скандия очень проста. Она включает кроме металла лишь одну степень окисления — Sc (IIl), представленную в кислой среде гидратированным ионом Sc3* (водн) и в щелочной — твердым гидратированным оксидом Sc203 • лН20. Более низкие степени окисления не обнаружены, они термодинамически совершенно невыгодны. Сами значения восстановительных потенциалов очень малы, это означает, что восстановить скандий до металла из водного раствора практически невозможно из-за восстановления воды до водорода, протекающего при значительно более высоких потенциалах (даже с учетом перенапряжения выделения водорода). В то же время металлический скандий с точки зрения термодинамики должен легко растворяться в кислотах и даже окисляться водой до Sc (III), но этот процесс не идег глубже поверхности металла, на которой образуется защитный слой нерастворимых продуктов окисления.
Обратимся теперь к титану. Судя по низким значениям потенциалов окисления титана, он должен легко растворяться в кислотах. Однако при обычных температурах металлический титан инертен, он растворяется в горячей соляной кислоте, переходя сразу в Ti (III), минуя состояние Ti (ll), так как сравнительно медленно образующийся Ti2* (водн) очень быстро окисляется водородными ионами до Ti (IIl) не только в кислой среде, но и в воде. Было бы неточно записать этот процесс в виде.
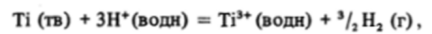
так как на самом деле Ti (III) в солянокислой среде образует комплексы типа ['ПОЯ(Н20)6.Я]3'Л, состав которых заметно зависит от концентрации хлоридных и водородных ионов.
Ti3* (водн) — гидратированный аквакомплекс титана (III) фиолетового цвета — устойчив в кислых растворах. Радиус иона Ti3* немного меньше, чем Sc3*. Соответственно Ti3* (водн) несколько более склонен к гидролизу, чем Sc3* (водн), однако гидратированный оксид Ti203 • лН20, который осаждается из растворов солей Ti (III) при добавлении оснований, не проявляет амфотерных свойств.
Ион Ti3* (водн) является мягким восстановителем, он окисляется кислородом воздуха, и поэтому растворы солей титана (III) хранят в инертной атмосфере.
Ti (IV) обладает настолько сильным электростатическим полем, что не способен существовать в виде негидролизованного аквакатиона, в разбавленной хлорной кислоте основные формы титана (IV) — это гидроксокомплексы [Ti (0H)2(H20)4)2+ и [Ti (0H)3(H20)3]*, которые можно рассматривать как продукты гидролиза [Ti (H20)6] .
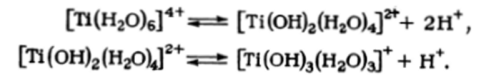
При увеличении pH идет дальнейший гидролиз, сопровождающийся полимеризацией, в результате чего осаждается гидратированный оксид ТЮ2 • /iH20. Он обладает амфотерными свойствами — одна из его форм, образующаяся на холоду (так называемая а-титановая кислота) растворяется в концентрированных щелочах.
Существуют многочисленные соли Ti (IV), в которых он входит в состав так называемого титанила — оксокатиона ТЮ2*, например сульфат титанила TiOS04 • Н20 — цепочечный полимер, в котором каждый атом титана связан с двумя мостиковыми титанильными атомами кислорода. Кислородные атомы сульфато-групп и воды занимают еще четыре координационные места у атомов титана, создавая вокруг них несколько искаженное октаэдрическое окружение.
Из схемы потенциалов (Приложение I) видно, что ни в кислой, ни в щелочной среде Ti (IV) не обладает окислительными свойствами, хотя это — высшая степень окисления титана, равная номеру группы.
«Водная» химия ванадия во многом схожа с химией титана, но, конечно, имеет свои особенности. Металлический ванадий, подобно титану, довольно инертен, он растворяется лишь в кислотах-окислителях — азотной, концентрированной серной и в царской водке, например:
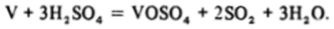
При растворении ванадий окисляется сразу до V (IV), состояния V (II) и V (III) «проскакиваются», так как соответствующие аквакатионы являются восстановителями по отношению к кислотам-окислителям (см. Приложение I). V2* (волн) разлагает воду с выделением водорода, а V3* (водн) окисляется кислородом воздуха. Ванадий (IV) в кислых водных растворах и в многочисленных твердых соединениях образует весьма устойчивую группировку оксованадия (1У) или ванадила V02*.
В твердом сульфате ванадила V0S04 • 5Н, 0, который можно выделить из раствора ванадия в концентрированной серной кислоте, атом ванадия находится в центре искаженного октаэдра из атомов кислорода, причем самая короткая связь VО реализуется в оксованадисвой группировке. Благодаря высокому заряду иона ванадия и его высокой электроотрицательности электронная плотность неподеленных пар иона О2' частично перетягивается на </<sub>я-орбитали иона V4*, т. е. возникает кратная координационная я-связь, в которой ион ванадия выступает в качестве акцептора, а ион кислорода — в качестве донора двух электронных пар (рис. 31.4).
Ванадильная группировка V02* сохраняется и при подщелачивании кислых растворов, содержащих аквакомплексы [ V0(H20)5]2*. При достаточной концентрации щелочи из раствора в осадок выпадает желтый гидроксид ванадила: 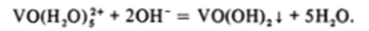
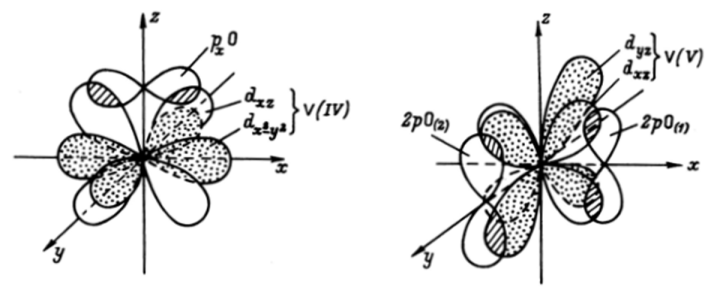
Рис. 31.4. p-связь V (IV)-Ob ионе VOa*.
Показана только составляющая связи в плоскости xz, такая же связь реализуется в плоскости уг. Несвязывающий clx2.yJ-электрон (обозначен точками) несколько затрудняет образование связей в плоскости ху
Рис. 31.5. я^.р-связи V (V)-Ob ионе V03
Показаны составляющие я-связей ванадия в вертикальных плоскостях xz с атомом O (i) и уг — с атомом 0(2). Кроме этого, в плоскости ху возможно образование я-связей с участием </<sub>Ху-орбиталей ванадия и рп-злек тронных пар обоих атомов кислорода В концентрированных щелочах образуется ион ванадзта (1У) VOj", из щелочных растворов могут быть выделены соли — ванадаты (1У) различного состава: • 7Н20, MnV03 и другие. Таким образом, в водных растворах V (IV) проявляет амфотерные свойства, образуя в зависимости от среды как катионы, так и анионы. Напомним, что оксид V02 реагирует и с кислотами и. с основаниями (табл. 31.4).
Термодинамически устойчивые соединения V02+ окисляются трудно (см. Приложение I), в кислой среде при этом образуется сложная смесь акватированных ионов диоксованадия V02 и продуктов их гидролиза, содержащих от одной до трех гидрок со групп, а также полимерные формы, главными из которых являются десятиядерные ионы. Выделенные из таких растворов ванадаты (У) имеют весьма различный состав, в частности получены соли Ca3V, oC>2e • I6H2O и K2Zn2V,0O2t • 16Н20, в структуре которых десять октаэдров V06 соединены между собой.
Группировка диоксованадия (V) VO^, подобно группировке V0J*. сохраняется во многих комплексах ванадия (У), например (V03CI4)*‘, IV0,(C, 04), P'. Во всех случаях она имеет цнс-строение. Как видно из рис. 31.5, ион V** с d° -электронной конфигурацией поставляет на образование я-донорно-екцепторных связей с двумя ионами кислорода все три-орбитали: d^ — для акцептирования р^-злектронов от одного иона кислорода (расположенного на осиy), dxz — отдругого (наоси х) и dxy — для акцептирования ря-электронов сразу от обоих ионов кислорода. В случае же гракс-расположения ионов кислорода возможно использование лишь двух dn -орбиталей.
По мере подщелачивания кислых растворов ванадия (V) гидролиз и полимеризация усиливаются, выше pH = 6,8 из раствора выпадает осадок V205 лН20. Лишь в сильнощелочных растворах (рН> 13) преимущественной формой существования V (V) является тетраэдрический ион ванадата VOJ".
В целом химия ванадия (V) в растворах позволяет считать V205 преимущественно кислотным оксидом, и все его производные проявляют довольно сильные окислительные свойства.
Следующий металл — хром — легко растворяется в обычных кислотах (разбавленных соляной, серной и других), но пассивируется окисляющими кислотами типа азотной и царской водкой. При растворении металлический хром обычно окисляется до состояния Сг (Ш).
Промежуточный продукт |Сг (Н, 0)41,# обладает очень сильными восстановительными свойствами и поэтому окисляется до [Сг (Н, 0)4)э* не только кислородом воздуха, но и водородными ионами, однако растворы солей хрома (Н) можно получить, если без доступа воздуха в достаточно разбавленных кислотах растворять очень чистый хром, полученный электролитическим путем Протекание реакиии.
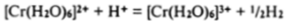
зависит от природы присутствующих в растворе примесей.
Ионы [Сг (Н20)6|3* легко гидролизуются (радиус свободного иона Сг3* равен радиусу иона Ti4*) с образованием ионов [Сг (Н20)50Н]24, которые проявляют склонность к димеризации. При дальнейшем увеличении pH идет более глубокий гидролиз и полимеризация, в итоге образуется амфотерный гидратированный оксид Сг2Оэ • п&. Его раствор в концентрированных щелочах содержит ионы [Сг (Н2ОХОН)5]2" и [Сг (ОН)6]3~. Кристаллические хромиты имеют состав МСг (ОН)4 и М2Сг (ОН)5, М = К, Na.
Соединения Cr (IV) и Cr (V) в водных растворах неустойчивы. Например, пентафторид хрома CrFs иоксофторхроматы (У) KCrOF4 и AgCrOF4 в присутствии воды гидролизуются и диспропорционируют:
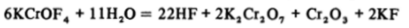
(это приближенное уравнение реакции), в зависимости от количества воды и других условий могут образовываться и другие формы Cr (VI) и Сг (Ш).
Соединения хрома (У1) характеризуются сильными окислительными свойствами, получить их в кислом растворе из соединений Сг (Ш) можно только с помощью таких сильных окислителей, как перманганат-ион. В кислой среде устойчив димерный ион дихромата Сг207, в котором атом хрома имеет почти правильное тетраэдрическое окружение из атомов кислорода, один из которых выступает в роли мостика. При подщелачивании раствора идет расщепление димера.
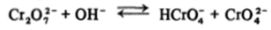
и нейтрализация НСЮ4
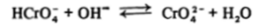
или в сумме: 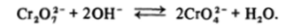
Таким образом, в щелочной среде устойчив ион СЮ4″, кислой — Сг202", в слабокислой заметно присутствие ионов HCrOJ.
Посмотрите на схему потенциалов хрома (Приложение I) и убедитесь, что дихромат-ион в кислой среде представляет собой сильный окислитель, а хромат-ион в щелочной практически не проявляет окислительных свойств. Например, в щелочном растворе Сг (Ш) может быть окислен до Cr (VI) бромом или даже иодом:
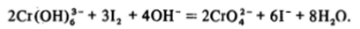
У следующего элемента — марганца — наблюдается наибольший набор окислительных состояний. «Водная» химия марганца принципиально похожа на химию предшествующих членов ряда: с повышением степени окисления наблюдается переход от катионов, обладающих восстановительными свойствами, к анионам-окислителям, переход от октаэдрического окружения к тетраэдрическому.
Металлический марганец легко растворяется в разбавленных кислотах: 
Бледно-розовые (практически бесцветные) растворы Мп2* (водн) или [Мп (Н20)6]2* устойчивы к окислению (см. Приложение 1), при подщелачивании из них выпадает осадок гидроксида Мп (ОН)2, обладающего слабыми амфотерными свойствами. В сильнощелочной среде он переходит в гидроксокомплекс [Мп (0Н)3(Н20)3)" .
Гидроксид марганца легко окисляется — белый осадок на воздухе темнеет из-за образования темно-бурого диоксида:
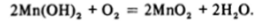
Мп (Ш) термодинамически неустойчив в водных растворах; как видно из схемы потенциалов, он диспропорционирует как в кислой, так и в щелочной среде:
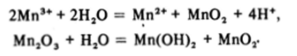
Диоксид марганца — устойчивое малорастворимое вещество темнобурого цвета, обладающее амфотерными свойствами. Мы уже встречались с ним в разд. 31.5, поэтому лишь отметим, что в лабораторной практике он часто используется как сильный окислитель, в частности для получения хлора: 
Состояние Mn (VI) в химии марганца представлено тетраэдрическим ионом манганата MnOj" зеленого цвета. В водных растворах при pH < 14 он неустойчив из-за диспропорционирования:

Однако в очень сильнощелочной среде (pH > 14) положение этого равновесия сдвигается влево, и манганат (У1) может существовать в растворе.
И, наконец, широко известный как сильный и удобный для лабораторных целей окислитель — перманганат-ион MnOi — представляет форму существования в растворах марганца в высшей степени окисления — Mn (VII). Это — анион сильной марганцевой кислоты НМп04, имеющий определенное сходство с хлорной кислотой. Окислить низшие соединения марганца до перманганата можно только самыми сильными окислителями типа РЬ02, NaBi03, КЮ4, например:

Водные растворы перманганата термодинамически неустойчивы, так как Мп04 окисляет воду:
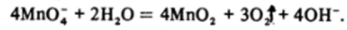
Реакция ускоряется на свету, поэтому растворы перманганата хранят в темной посуде. В кислой среде перманганат обычно восстанавливается до Мп2+, например:
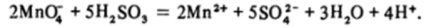
В нейтральной и щелочной средах даже при избытке восстановителя реакция идет только до Мп02 :
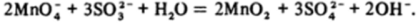
В щелочном растворе при этом исходная малиновая окраска меняется сначала на зеленую, присущую манганату (У1), а потом выпадает темнобурый осадок диоксида марганца. С точки зрения термодинамики избыток такого восстановителя, как ион сульфита в щелочной среде (/Гщ = = -0,93 В), способен восстановить перманганат до Мп (ОН)2, однако это не происходит из-за присутствия кислорода воздуха, который, как отмечено выше, окисляет гидроксид марганца (И) до диоксида.
В очень сильнощелочных средах (pH > 14) при недостатке восстановителя перманганат восстанавливается до манганата:
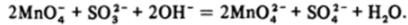
После марганца число состояний окисления у переходных элементов первого ряда резко снижается. Железо в кислой среде может быть окислено только до состояния Fe (III), а в щелочной — до Fe (VI). Способность металлического железа окисляться во влажном воздухе всем хорошо известна. Железо легко растворяется в разбавленных кислотах, образуя катионы [Fe (H20)]|+ бледно-зеленого цвета, которые далее медленно окисляются кислородом воздуха. Увеличение концентрации водородных ионов замедляет эту реакцию. При подщелачивании же из раствора осаждается почти бесцветный гидроксид Fe (OH)2, который темнеет на глазах из-за окисления кислородом воздуха:
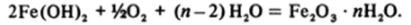
В кислой среде железо окисляется до Fe3* (водн) под действием окислителей средней силы. Например, при действии на железо разбавленной азотной кислоты (в концентрированной азотной кислоте и других сильных окислителях оно пассивируется) идет процесс: 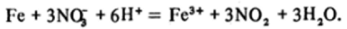
Радиус иона Fe3* составляет 0,064 нм (как у Ti4*), поэтому акваион [Fe (H20)6]3* сильно склонен к гидролизу. При этом идут процессы последовательного отщепления протонов.
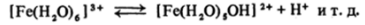
(здесь [Fe (H20)e]3+ выступает как кислота с Км = КГ3) и полимеризации, например:
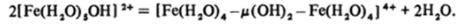
При увеличении pH образуются более сложные многоядерные полимеры и далее осаждается красно-коричневый студенистый гидратированный оксид Fe203 • лН20. Из осадка можно выделить, в частности, гидроксидоксид FeO (OH).
Fe203 обладает амфотерными свойствами, его гидраты Fe203 • п Н20 растворяются не только в кислотах, но и в щелочах, образуя в основном анион [Fe (OH)6]3". Из щелочных растворов можно получить твердые соли — ферраты (Ш) состава M!Fe02 и [Fe (OH)6]2.
Железо (Ш) в кислой среде представляет собой окислитель, способный количественно окислить I" до 12. Сам акваион [Fe (H20)6]3* далее нельзя окислить в кислом растворе, но в щелочной среде Fe (III) не обладает окислительными свойствами и может быть само окислено до ферратионов FeOj" под действием таких окислителей, как С12, или электролитически. Тетраэдрические ионы FeOj" довольно устойчивы в сильнощелочной среде; благодаря перенапряжению выделения кислорода реакция.
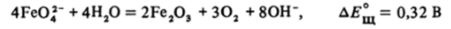
практически не идет. В нейтральной и кислой средах феррат-ион быстро окисляет воду с выделением кислорода:
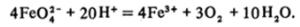
Твердые ферраты (VI) могут быть выделены из щелочных растворов.
Кобальт более стоек к действию кислот, чем марганец и железо, он медленно растворяется в разбавленных соляной и серной кислотах и несколько быстрее в разбавленной азотной, образуя акваионы [Со (Н20)6]2*. Из таких растворов при кристаллизации обычно выделяются гидраты солей кобальта (Н), например Co (N03)2 • 6Н20 — фактически [0o (H2O)6](NO3)2, в которых ион Со2* с электронной конфигурацией d7 = tgeyg имеет искаженное октаэдрическое окружение. Малорастворимый гидроксид Со (ОН)2 может существовать в двух формах — менее термодинамически устойчивой голубой, которая осаждается из растворов солей кобальта (П) при добавлении к ним щелочи при 0 °C, и более устойчивой — розовой. Со (ОН)2 амфотерен, он растворяется в концентрированных щелочах, образуя ионы [Со (ОН) 4]2" .
Окислить ион [Со (Н20)6]2* в кислом водном растворе невозможно, так как потенциал Е^*^" очень высок, он составляет +1,82 В, и легче, чем Со2*, будет окисляться вода. Однако в комплексообразующих средах потенциал Со (И1)/Со (Н) существенно ниже (см. разд. 31.8).
Гидратированный оксид Со203 • пН20 осаждается щелочами из растворов солей Со (Ш), мягким окислением Со (ОН)2 можно получить черный гидроксид-оксид СоО (ОН). Оксид Со203 • лН20 не обладает сильными окислительными свойствами и может существовать в равновесии со щелочными водными растворами. При действии на него сильных окислителей в щелочном растворе, по-видимому, образуется диоксид Со02 или его раствор в Со203.
Следующий в ряду металл — никель — имеет еще более скромную «водную» химию: она сопряжена лишь с одним состоянием окисления Ni (II), устойчивым в водных средах. Металл легко растворяется в разбавленных кислотах, переходя в аквакатион [Ni (H20)6]2" В концентрированной азотной кислоте никель пассивируется; в компактном виде (не в порошке) он также устойчив при комнатной температуре к действию воздуха и воды, поэтому никелирование наряду с хромированием широко используется для защиты железных и стальных изделий от коррозии.
При подщелачивании растворов, содержащих Ni2* (водн), осаждается гидроксид ЩОН^ в виде зеленого студенистого осадка, легкорастворимого в кислотах и водном аммиаке (с образованием амминокомплексов), но практически нерастворимого в избытке щелочи. Дальнейшее окисление никеля возможно лишь в щелочном растворе (см. Приложение I) при заметном перенапряжении выделения кислорода. При этом образуется смесь гидратированных оксидов Ni (III) и Ni (IV). При очень высоких концентрациях щелочи, вероятно, может быть получен оксид Ni203, но в чистом виде он не выделен. При действии щелочи на раствор Ni (N03)2 в присутствии брома можно получить гидроксид-оксид NiO (OH) в виде черного порошка:
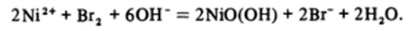
Это соединение используется в щелочных аккумуляторах — железо-никелевом, изобретенном Эдисоном, и кадмий-никелевом. Основные процессы, протекающие в щелочных аккумуляторах, описываются уравнением:
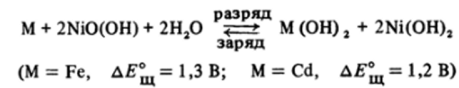
При дальнейшем обезвоживании NiO (OH) разлагается:

Медь заметно отличается от предшествующих переходных элементов первого ряда склонностью к образованию соединений Си (1). В кислых водных растворах, однако, ион Си+ (водн) неустойчив по отношению к диспропорционированию:
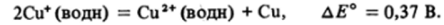
Металлическая медь растворяется в кислотах-окислителях азотной и серной, образуя акваион [Си (Н20)6]2+, например: 
Медь (1) в кислом растворе может быть стабилизирована за счет ком* плексообразования (см. разд. 31.8), так же устойчивы в равновесии с водными растворами некоторые труднорастворимые соли Си (1) и в щелочной среде — нерастворимый оксид Си20.
В кислой некомплексообразующей среде ионы Си2* (вода) представляют единственную термодинамически устойчивую растворимую форму меди. Растворы солей меди (II) окрашены в характерный голубой или зеленый цвет.
Среди них, вероятно, наиболее известен сульфат, который обычно служит исходным препаратом для получения остальных соединений меди. Из водного раствора он кристаллизуется в виде голубого пентагидрата CuS04 • 5Н30, известного как «медный купорос». Он применяется для борьбы с вредителями в сельском хозяйстве, для изготовления минеральных красок.
В щелочной среде из растворов солей меди (II) могут быть осаждены основные соли, голубой гидроксид Си (ОН)2 получают, прибавляя аммиак к холодному раствору сульфата меди (Н). Гидроксид меди нерастворим в воде и разбавленных щелочах. В концентрированных растворах щелочей он слегка растворяется.
Си (ОН)г может быть окислен до растворимых соединений меди (III) (по-видимому, в основном купрат (Н1)-иона Си02) действием гипохлорита в щелочном растворе. При подкислении растворы купратов (Ш) быстро разлагаются с выделением кислорода.
Последний элемент первой вставной декады — ц и н к — по существу не принадлежит к-элементам, так как его единственное устойчивое состояние окисления +2, и ион Zn2* имеет замкнутую 3d10-оболочку. Это обстоятельство предопределяет и довольно простую «водную» химию цинка. Металлический цинк легко растворяется в обычных кислотах с выделением водорода, что иногда используют для лабораторного получения водорода:
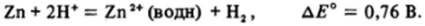
Цинк также растворяется и в щелочах:
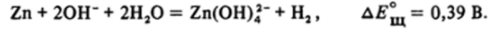
Гидроксид цинка Zn (OH)2 легко растворяется в избытке щелочи.
Благодаря низким значениям потенциалов окисления цинк применяется в целом ряде химических источников тока — гальванических элементах (см. разд. 18.6) и серебряно-цинковых аккумуляторах, действие которых основано на реакции:
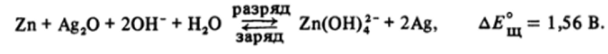
Итак, мы рассмотрели кислотно-основные и окислительно-восстановительные свойства важнейших форм, образуемых при растворении переходных металлов первого ряда в кислотах и при их дальнейшем окислении. Как правило, при растворении металлы переходят в состояние окисления М (П), а именно — в гидратированные аквакатионы [М (Н20) 6]2* (вода).
Исключение составляет скандий, который сразу переходит в Sc (III). У титана, ванадия и хрома аквакатионы [М (Н20)6]2*, хотя и существуют, но обычно также «проскакиваются» при растворении металла (особенно на воздухе), и при этом сразу образуются гидратированные аквакатионы [ М (Н20) 6 ]3 * (водн).
Аквакатионы, образуемые М (Н) и М (Ш), легко гидролизуются, склонность к гидролизу возрастает с увеличением заряда и уменьшением радиуса иона. Гидролиз начинается с отщепления протона одной из внутрисферных молекул воды, затем отщепляется еще один — в случае М (П) — или два — в случае М (Ш) — протона и параллельно развивается полимеризация. Далее осаждается малорастворимый гидроксид М (ОН)2 или гидратированный оксид М203 • иН20. Гидроксиды М (ОН)2, как правило, не обладают амфотерными свойствами. Лишь гп (ОН)г легко растворяется в щелочах. Большинство гидратированных оксидов М203 • лН20,а также М02 • лН20 (М = Ti, V, Мп) амфотерны. Оксиды, в которых степень окисления металла превышает +4, обладают кислотными свойствами и дают в растворах анионные формы.
Что касается окислительно-восстановительных свойств, то низшие формы — производные М (Н) первой половины ряда — до марганца, а также Fe (II) и Cu (I) представляют собой восстановители. Высшее состояние окисления и окислительные свойства соответствующих соединений растут от начала ряда до марганца включительно. Далее высшее состояние окисления падает, но зато его носители — производные Fe (VI), Co (IV), Ni (IV) и Cu (III) — представляют собой чрезвычайно сильные окислители.