Общая характеристика элементов 17-й группы

В отличие от хлора фтор вообще не образует оксоанионов. Бром и иод в кислых растворах помимо простых анионов Вг и I образуют оксоаниоиы Вг03, Ю3 и Ю4. Бромная кислота — НВг04 — менее устойчива, чем хлорная. Для иода, кроме НЮ4, известны формы с более высокими координационными числами, в частности Н5Ю6. Групповое название этих элементов — галогены («рождающие соли») — связано с тем, что… Читать ещё >
Общая характеристика элементов 17-й группы (реферат, курсовая, диплом, контрольная)
Групповое название этих элементов — галогены («рождающие соли») — связано с тем, что большинство их соединений с металлами, подобно хлоридам, представляют собой типичные соли. Распространенность галогенов в природе не слишком велика и уменьшается от фтора к иоду.
Изменение химических свойств в ряду At—I—Br—С1 в основном определяется закономерным уменьшением размеров ns— и я/?-валентных орбиталей, но при переходе от хлора к фтору, кроме того, резко меняется состояние всей электронной оболочки, так как в атоме фтора отсутствуют остовные /^-электроны и вакантные d-АО. Следствием этого является заметное отличие свойств фтора от свойств остальных элементов группы. В частности, энергия связи F—F аномально мала (159 кДж/моль), заметно меньше, чем у хлора (242 кДж/моль) и брома (192 кДж/моль). Это делает молекулу F2 исключительно реакционноспособной: фтор непосредственно реагирует со всеми элементами, кроме Не, Ne и Аг, образуя в большинстве случаев соединения, в которых элементы находятся в максимально возможных степенях окисления: BiF5, SF6, OsF7, причем многие реакции со фтором идут уже при стандартных условиях.
Бром и иод менее реакционноспособны, чем фтор и хлор, но все-таки и они реагируют с большинством элементов, часто при условиях, близких к стандартным.
Соединения галогенов с водородом газообразны при обычных условиях. Прочность связи Н—Гал уменьшается от HF к Н1 (569 и 298 кДж/моль). Полярность связи достаточно велика, поэтому галогеноводороды хорошо растворимы в воде. В растворах они практически нацело диссоциированы. Только фтороводород из-за большой прочности связи Н—F и сильных водородных связей оказывается слабой кислотой: Ка = 6−10~4.
Ионы Гал" ведут себя как восстановители, сила которых растет от С1 к I", что хорошо видно из сравнения значений восстановительных потенциалов:
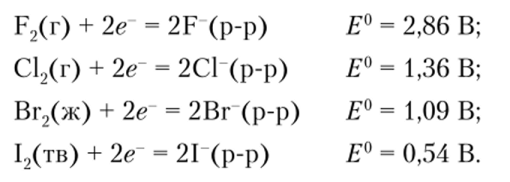
Например, ионы Вг~ и I" при реакциях с концентрированной серной кислотой ее восстанавливают, а ион CF — нет:
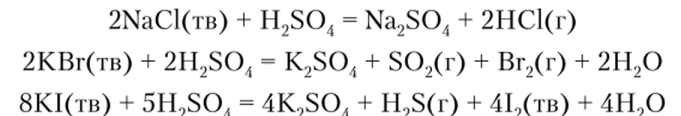
По этой причине в лабораторных условиях НВг и HI получают в основном гидролизом галогенидов неметаллов:
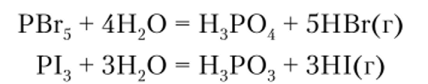
Ионы иода окисляются высокозарядными катионами, и высшие иодиды многих металлов не существуют в водных растворах. Например:
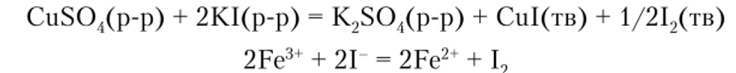
Соединения с кислородом для брома менее характерны, чем для хлора, — практически все оксиды брома неустойчивы и разлагаются уже ниже 0 °C. Напротив, иод образует термодинамически устойчивый оксид 1203 (ДHf = = -183 кДж/моль).
Химия водных растворов для брома, иода и их соединений не столь разнообразна, как химия хлора.
В отличие от хлора фтор вообще не образует оксоанионов. Бром и иод в кислых растворах помимо простых анионов Вг и I образуют оксоаниоиы Вг03, Ю3 и Ю4. Бромная кислота — НВг04 — менее устойчива, чем хлорная. Для иода, кроме НЮ4, известны формы с более высокими координационными числами, в частности Н5Ю6.
В щелочных растворах бром и иод, подобно хлору, диспропорциопируют с образованием триоксогалогенатов (У):
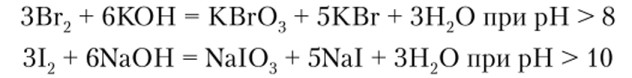
Все оксогалогенатные анионы проявляют в растворах окислительные свойства, восстанавливаясь до ионов Гал- или свободных галогенов.
Резюме
Хлор — яркий представитель p-элементов. Во всех своих многочисленных степенях окисления он проявляет только аниопогенные свойства. Если вы поймете, как и почему меняются свойства соединений хлора в зависимости от степени окисления, то вы легко обнаружите аналогичные закономерности в химии других «типических» элементов.
Практикум
Вопросы для самоконтроля
- 1. Из всех атомов атом хлора имеет самое большое сродство к электрону. Как это можно объяснить?
- 2. Объясните, почему фтороводород, являясь одноосновной кислотой, образует кислые соли, например KIIF2. Почему НВг не может давать таких солей?
- 3. Объясните, как и почему меняется сила кислот в ряду ПСЮ, IIBrO, НЮ?
Аналитические задания
- 1. Рассмотрите все возможные варианты диспропорционирования НС10 в зависимости от условий.
- 2. Хороню известно, что галоген с меньшим атомным номером окисляет ион галогена с большим атомным номером. Используя восстановительные потенциалы галогенов, покажите, что С12 может окислить 1~, но 12 не может окислить Вг.
Задачи для самостоятельного решения
1. Хлор можно достаточно легко последовательно окислить до НС10, НСЮ3 и даже до НСЮ4. Но восстановление НС104, как правило, идет сразу до НС1. Исходя из диаграммы восстановительных потенциалов объясните, почему так происходит.
2. Конкуренция хлора и кислорода как окислителей очень хорошо отражается равновесием 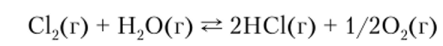
константа которого равна единице при 1000 К: а) определите знак AS реакции;
- б) используя формулу (12.5), найдите знак АН реакции; в) на основании принципа Ле Шателье рассмотрите, как будет смещаться равновесие при изменении температуры; г) укажите, в каких условиях кислород, а в каких хлор является более сильным окислителем.
- 3. Как меняется энергия диссоциации молекул Х2 в ряду F — I? Энергия диссоциации какой из молекул: F2 или С12 — нарушает монотонную последовательность в изменении энергии диссоциации?