Учение об адсорбции

Часто в литературе можно встретить утверждение, что физическая адсорбция — обратимая, а хемосорбция — необратимая. Оно некорректно: хемосорбция, как и любая химическая реакция, идет до установления равновесия, когда скорость адсорбции равна скорости десорбции. Термин «необратимая адсорбция» следует использовать лишь в тех случаях, когда химическая природа адсорбирующихся и десорбирующихся молекул… Читать ещё >
Учение об адсорбции (реферат, курсовая, диплом, контрольная)
Основные понятия и определения
Процесс самопроизвольного концентрирования газов или растворенных веществ на поверхности раздела фаз называют адсорбцией.
В зависимости от природы контактирующих фаз различают адсорбцию на поверхностях «газ — твердое тело», «жидкость — твердое тело», «газ — жидкость» и «жидкость — жидкость».
Вещества, поверхность которых адсорбирует, называют адсорбентами, а вещества, которые адсорбируются, — адсорбатами (иногда — адсорбтивами)[1]. Например, при адсорбционной очистке сахарного сиропа на активированном угле уголь служит адсорбентом, а молекулы удаляемых примесей — адсорбатом.
Часто концентрирование веществ не ограничивается поверхностью, и молекулы адсорбата проникают вглубь фазы адсорбента. В этом случае мы сталкиваемся с явлением абсорбции. Так, молекулы углекислого газа С02, первоначально адсорбированные из газовой фазы на поверхности воды, распределяются далее во всем объеме жидкости — абсорбируются. Совокупность процессов адсорбции и абсорбции называют сорбцией (часто сорбцией называют и каждый из указанных процессов порознь).
Поглощение влаги хлебопродуктами является результатом адсорбции и набухания. С белковыми компонентами муки влага способна взаимодействовать, увеличивая их массу вдвое. Из этого количества менее 25% связывается адсорбционно, остальная часть впитывается осмотически, т. е. в результате набухания. Таким образом, одновременно наблюдаются и адсорбция, и абсорбция в форме набухания.
Процесс адсорбции (сорбции) идет до установления равновесия, когда скорость прямого процесса равна скорости обратного процесса, — десорбции (когда число молекул адсорбата, появляющихся на поверхности в единицу времени, равно числу молекул, покидающих ее).
Взаимодействия, приводящие к адсорбции, очень разнообразны, но можно выделить две группы, вызываемые преимущественно взаимодействиями физической или химической природы. Физическая, или ван-дер-ваальсова, адсорбция вызывается теми же силами, что и молекулярные взаимодействия, т. е. силами притяжения постоянных и индуцированных диполей. Энергии такого взаимодействия недостаточно для разрыва химических связей, и, таким образом, при физической адсорбции молекула сохраняет свою индивидуальность, хотя она может быть деформирована в энергетическом поле поверхности.
Химическая адсорбция, или хемосорбция, вызывается силами, возникающими в результате перераспределения электронных орбиталей молекул адсорбата и адсорбента, т. е. обусловлена образованием химических связей. В соответствии с этим хемосорбцию можно определить как химическое взаимодействие газов или растворенных веществ с поверхностью твердых тел, не приводящее к образованию новой объемной фазы. Процесс ржавления металлов с этой точки зрения нельзя считать хемосорбцией, ржавчина — новая объемная фаза оксидов и гидроксидов металла. В результате хемосорбции образуется лишь мономолекулярный (толщиной в одну молекулу) слой химически связанного с поверхностью металлов атомов кислорода.
Хемосорбированная молекула может разорваться на отдельные фрагменты и таким образом потерять свою индивидуальность. Существование молекулярных осколков на поверхности, образующихся при хемосорбции целых молекул, является одной из причин проявления поверхностью каталитической активности (явление гетерогенного катализа).
Установлен ряд приближенных критериев, совокупность которых позволяет на основании экспериментальных данных различить физическую и химическую адсорбции:
- 1) физическая адсорбция происходит под влиянием сил Ван-дерВаальса и по своей природе аналогична процессам конденсации паров адсорбата. Поэтому теплота ее близка к теплотам конденсации и составляет -(5—40) кДж/моль. Теплота хемосорбции соизмерима с теплотами химических реакций и составляет обычно -(80—400) кДж/моль. Однако хемосорбция из жидких растворов может сопровождаться выделением теплоты, близкой к теплоте физической адсорбции. Таким образом, если наблюдаемые теплоты адсорбции превышают -80 кДж/моль, то можно с достаточной уверенностью утверждать, что исследуемое явление — хемосорбция. Нельзя, однако, делать вывод о физической природе адсорбции в случае малой величины ее теплоты;
- 2) температурная область протекания физической адсорбции не может значительно превышать температуру кипения адсорбата при давлении опыта. Так, при атмосферном давлении физическая адсорбция воды ограничена ~Ю0°С. Хемосорбция же может происходить как при низких, так и при гораздо более высоких температурах;
- 3) физическая адсорбция на непористых адсорбентах протекает практически мгновенно, и скорость ее слабо зависит от температуры. Хемосорбция, как и любая химическая реакция, протекает через образование активированного комплекса с преодолением энергии активации, т. е. является активированной адсорбцией. Скорость такой адсорбции сильно зависит от температуры (эта зависимость передается уравнением Аррениуса). Однако бывают случаи, например, при хемосорбции кислорода и водорода на поверхности металлов, когда адсорбция протекает очень быстро и практически без зависимости ее скорости от температуры;
- 4) однозначным критерием установления природы адсорбции является отсутствие значительной температурной зависимости скорости десорбции. Энергия активации десорбции равна сумме энергии активации адсорбции и теплоты адсорбции. Слабая зависимость скорости десорбции от температуры возможна лишь при малых величинах как энергии активации, так и теплоты адсорбции, а это характерно лишь для физической адсорбции;
- 5) физическая адсорбция не специфична: она происходит на любых поверхностях (если температура опыта ниже температуры кипения адсорбата). Благодаря этой особенности физическая адсорбция и может быть использована для измерения общей поверхности твердых тел. В противоположность этому хемосорбция происходит только на тех адсорбентах, с поверхностями которых возможно химическое взаимодействие адсорбата (между ними имеется химическое сродство);
- 6) физическая адсорбция может приводить к образованию полимолекулярных пленок (полимолекулярной адсорбции), так как силы взаимодействия в последующих слоях практически не отличаются от сил взаимодействия в первом слое. При хемосорбции химическое взаимодействие требует непосредственного контакта адсорбата с поверхностью, и возможность полимолекулярной адсорбции исключается. Однако количество адсорбированного вещества при хемосорбции может в некоторых случаях превышать однослойное покрытие вследствие проникновения адсорбата на некоторую глубину приповерхностного слоя в междоузлия кристаллической решетки адсорбента. Так, при хемосорбции кислорода на серебре или платине адсорбированное количество может более чем в 3 раза превышать число атомов кислорода, отвечающее монослойному покрытию поверхности. При этом не образуется объемная фаза оксида. Это явление отличается также от растворения во всем объеме металла (абсорбции), так как ограничивается лишь приповерхностным слоем, а количество поглощенного в нем адсорбата значительно превышает равновесную растворимость. В рассмотренных случаях проникновение атомов адсорбата на определенную глубину, по-видимому, облегчается деформацией решетки металла вблизи поверхности;
- 7) химическая адсорбция локализована, т. е. на каждом центре адсорбции поверхности может адсорбироваться только одна молекула адсорбата (поверхность можно представить шахматной доской, на каждой клетке которой может находиться только одна фигура). Физическая же адсорбция нелокализована, т. е. в этом случае нет жесткой связи молекул адсорбата и центров адсорбции. На поверхности существует как бы двумерная пленка жидкости. Однако при хемосорбции часто наблюдают явление спилловера — «переползания» хемосорбированных частиц с одних центров адсорбции на другие.
Приведенные критерии, рассматриваемые в отдельности, не всегда позволяют однозначно охарактеризовать тип адсорбции, но примененные совместно обычно помогают надежно отличать физическую адсорбцию от хемосорбции. Нужно, однако, иметь в виду, что при отсутствии резкой границы между явлениями физического и химического взаимодействия возможна адсорбция, характеризующаяся промежуточными свойствами между физической адсорбцией и хемосорбцией.
Часто в литературе можно встретить утверждение, что физическая адсорбция — обратимая, а хемосорбция — необратимая. Оно некорректно: хемосорбция, как и любая химическая реакция, идет до установления равновесия, когда скорость адсорбции равна скорости десорбции. Термин «необратимая адсорбция» следует использовать лишь в тех случаях, когда химическая природа адсорбирующихся и десорбирующихся молекул различна (молекулы распадаются на фрагменты и при десорбции с поверхности выделяются совсем другие частицы). Так, при десорбции хемосорбированного на платине бензола с поверхности удаляется целый набор углеводородов — от метана до циклогексана.
Количественно адсорбцию обычно выражают двумя способами. Абсолютная адсорбция а — это общее количество адсорбата в поверхностном слое единицы площади или единицы массы адсорбента (иногда единицы объема). Единицами измерения а являются моль/м2, моль/г или моль/см3. Экспериментально а определяют весовым методом (например, на весах Мак-Бена) при изучении адсорбции из газовой фазы на твердом адсорбенте. Понятно, что увеличение массы (пересчитанное в моль) адсорбента, подвешенного на весах, равно именно а.
Избыточная адсорбция (гиббсова адсорбция) Г — это избыток адсорбата в поверхностном слое единицы площади поверхности или единицы массы адсорбента по сравнению с его равновесным количеством в равном объеме внутри фазы. Измеряют избыточную адсорбцию в моль/м2, моль/г или моль/см3. Экспериментально Г определяют по разности концентраций адсорбата в растворе до и после адсорбции (как это делается в лабораторном практикуме).
По своему физическому смыслу а всегда положительна (а > 0). Значение же Г может быть, как положительным (вещество концентрируется на поверхности), так и отрицательным (вещество избегает поверхности, как в случае адсорбции ПИВ). По определению а всегда больше Г, но при малых концентрациях адсорбата (можно пренебречь количеством вещества в слое фазы по сравнению с количеством его у поверхности) и сильной его адсорбции а ~ Г. Обычно это наблюдается в водных растворах ПАВ.
В общем случае адсорбция является функцией давления Р (для газов) или концентрации С (для жидких растворов) и температуры, т. е. изображается на плоскости в координатах а = /(Р, Г) или Г = ДС, Г). Обычно один из параметров поддерживают постоянным и адсорбцию графически изображают в виде следующих кривых (рис. 3.1):
- • изотерма — зависимость адсорбции от давления газа или от концентрации раствора при постоянной температуре;
- • изобара — зависимость адсорбции от температуры при постоянном давлении газа (изопикна — при постоянной концентрации);
- • изостера — зависимость давления (или концентрации) от температуры при постоянной адсорбции.
На практике для графического изображения адсорбции чаще всего используют изотермы.
Степень заполнения (покрытия) поверхности 0 определяет, какая часть поверхности адсорбента покрыта молекулами адсорбата. Если на поверхности единицы площади или единицы массы адсорбента всего может поместиться а°° моль адсорбата (емкость монослойного покрытия), то для данной наблюдаемой адсорбции а: 0 = а/ах или 0 = Г/Г^ (в случае избыточной адсорбции).
Следующей количественной характеристикой адсорбции является интегральная теплота адсорбции Qa = АаН = На2 -Наг. Она равна изменению энтальпии системы «адсорбат — адсорбент» при увеличении адсорбции от а! до а2. Величину Qa обычно относят к площади поверхности адсорбента (если она известна) или к массе адсорбента и измеряют в Дж/м2 или Дж/г. Теплота при адсорбции всегда выделяется, за исключением крайне редких случаев эндотермической хемосорбции. Действительно, для адсорбции как самопроизвольного процесса:
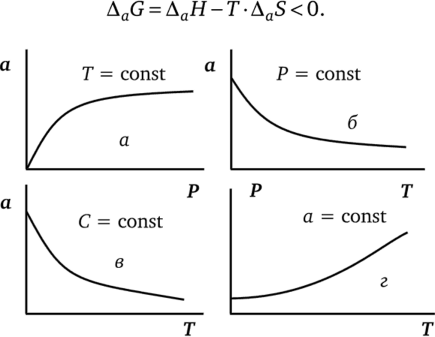
Рис. 3.1. Графическое изображение адсорбции:
а — изотерма; б — изобара; в — изопикна; г — изостера Поскольку адсорбат переходит в более упорядоченное состояние, адсорбция сопровождается уменьшением энтропии (AaS < 0).
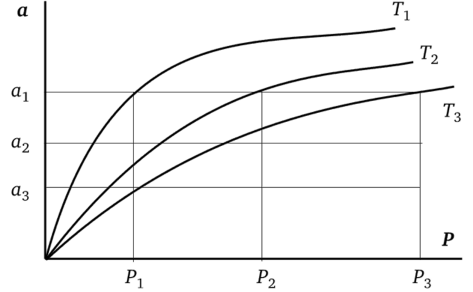
Рис. 3.2. Определение дифференциально-молярной изостерической теплоты адсорбции из изотерм адсорбции (Г3 > Т2 > Г,).
Поэтому для выполнения условия самопроизвольности процесса AaG < 0 всегда АаН < 0, при этом |АаН| > |Т • AaS|. Этот вывод очень важен для дальнейшего изложения материала. Он означает, что, как и для любого экзотермического процесса, с повышением температуры равновесие «адсорбция — десорбция» смещается в сторону десорбции (согласно правилу Ле Шателье), т. е. величина адсорбции (а или Г) с повышением температуры уменьшается.
Обычно при обсуждении теоретических вопросов адсорбции используют понятие дифференциально-молярной изостерической теплоты адсорбции qst. Она равна количеству энергии, выделяющейся в форме теплоты при адсорбции 1 моля адсорбата на бесконечно большой поверхности адсорбента (настолько большой, что адсорбция 1 моля не изменяет степени заполнения 0). Постоянство 0 или а — условие изостеричности процесса.
Величину Qad обычно измеряют в результате прямых экспериментов в калориметрах, значение же qst получают из изотерм адсорбции при различных температурах (в прямых экспериментах нельзя обеспечить условие 0 = const при адсорбции 1 моля — реальная поверхность не может быть бесконечно большой). Для этого на графике зависимости а = /(Р) или Г = /© проводят ряд линий — изостер при а = const (линии, параллельные оси абсцисс). Это видно на рис. 3.2.
Из точек пресечения изостер с изотермами для всех изотерм адсорбции определяют Рь Р2, Р3 и т. д. (каждому значению Т соответствует свое значение Р). На рис. 3.2 даны построения для изостеры аг Далее полученные данные располагают в координатах In Р против 1 /Т (рис. 3.3). Дифферециально-молярную изостерическую теплоту адсорбции qst (на рисунке — для адсорбции аД определяют из тангенса угла наклона полученной прямой qst = R • tg ос. Аналогично вычисляют дифференциальные теплоты и для других значений а.
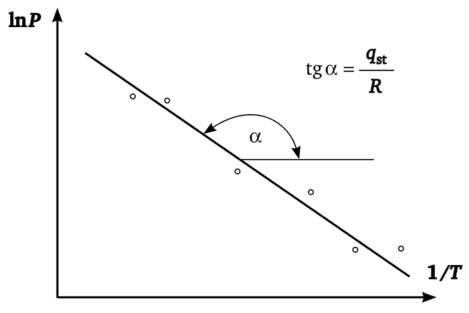
Рис. 3.3. Графическое определение qst.
- [1] На заре изучения адсорбционных явлений различали вещество, которое ужеадсорбировалось на поверхности, — адсорбат, и которое находится в газовой или жидкой фазе, — адсорбтив. Но в настоящее время получил распространение лишь один термин — адсорбат.