Изотермы поверхностного натяжения и изотермы адсорбции ПАВ на поверхности «жидкость — газ»
Согласно уравнению (3.28) при одинаковой адсорбции Г все гомологи уменьшают, а на одинаковую величину. Различие поверхностной активности в гомологическом ряду ПАВ обусловлено различной способностью их к адсорбции, т. е. одно и то же значение Г достигается для короткоцепочечных ПАВ при значительно больших С, чем для длинноцепочечных ПАВ. Но если концентрации у гомологов таковы, что их адсорбции… Читать ещё >
Изотермы поверхностного натяжения и изотермы адсорбции ПАВ на поверхности «жидкость — газ» (реферат, курсовая, диплом, контрольная)
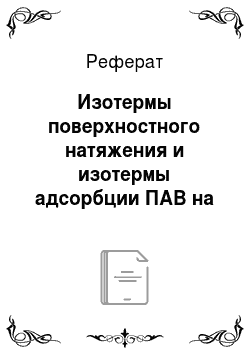
В 1908 г Б. Шишковский провел исследование зависимости поверхностного натяжения водных растворов низших жирных кислот (углеводородная цепь состояла из трех — шести группСН2-) от их концентрации С. Результаты его опытов представлены на рис. 3.18.
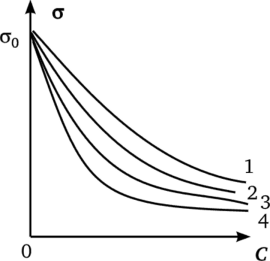
Рис. 3.18. Изотермы поверхностного натяжения кислот в воде:
1 — пропионовой; 2 — масляной; 3 — валериановой; 4 — капроновой Б. Шишковский установил, что полученные данные могут быть описаны эмпирическим уравнением (уравнение Шишковского):
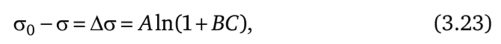
где g0 — поверхностное натяжение чистой воды; С — концентрация ПАВ; А, В — эмпирические константы уравнения. Оказалось, что константа А остается постоянной для всех членов гомологического ряда, а константа В увеличивается в 3—3,5 раза при удлинении углеводородной цепи на одно звеноСН2-.
Графически дифференцируя кривые, полученные Шишковским, а также используя собственные данные, Ленгмюр рассчитал по уравнению Гиббса (3.22) изотермы адсорбции исследованных ПАВ. Изотермы приведены на рис. 3.19.
Рис. 3.19. Изотермы адсорбции кислот в воде:
1 — пропионовой; 2 — масляной; 3 — валериановой; 4 — капроновой При одинаковой концентрации адсорбция ПАВ тем больше, чем длиннее углеводородная цепь (кривая расположена выше), но для всех членов гомологического ряда кривые стремятся к одному и тому же пределу Г,", называемому предельной адсорбцией, или емкостью монослоя.
Оказалось, что величина Г*, не зависит от температуры и природы поверхности раздела фаз («газ — жидкость» или «жидкость — жидкость»). Постоянство для всех членов ряда, на первый взгляд, удивительно, так как означает, что на единице поверхности помещается одно и то же число адсорбированных молекул, независимо от их размера. Казалось бы, чем больше молекула по размерам, тем меньше их должно помещаться на единице площади и тем меньше Г^.
Факт постоянства Г*, для всех членов гомологического ряда карбоновых кислот, установленный экспериментально, позволил Ленгмюру выдвинуть представления об ориентации адсорбированных молекул в поверхностном слое и распространить уравнение изотермы, выведенное им для адсорбции на твердых адсорбентах, и на поверхность «жидкость — газ». Действительно, кривые на рис. 3.19 имеют вид гипербол и могут быть описаны изотермой Ленгмюра:

где b — адсорбционный коэффициент; Гге — емкость монослоя.
Для объяснения постоянства у всех членов гомологического ряда Ленгмюр предположил, что углеводородная цепь ПАВ не занимает места в поверхностном слое — неполярные части «торчат» в воздух, образуя «молекулярный частокол», как это показано на рис. 3.20. В таком случае Г*. определяется лишь площадью (размерами) полярной группы S0, а она у всех гомологов одна и та же.
Если представления Ленгмюра верны, то величину S0 можно рассчитать из адсорбционных измерений. Действительно, произведение IV Na равно числу молекул ПАВ, находящихся на 1 м2 поверхности жидкости при полном ее покрытии, тогда Гх • NA S0 = 1 м2. Следовательно,.

Здесь Na — число Авогадро.
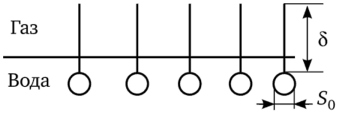
Рис. 3.20. Ориентация молекул ПАВ на поверхности «вода — воздух».
Были проведены многочисленные проверки уравнения (3.25) для поверхностей «газ — жидкость» и «жидкость — жидкость». Так, для п-толуидина S0 = 25,4- Kh20 м2 на границе «водный раствор — воздух», S0 = 24,6 • 10-20 м2 на границе «водный раствор — н-гексан» и S0 = = 28,1 • 1020 м2 на поверхности «водный раствор — бензол». Все приведенные значения S0 близки к найденным другими независимыми методами. Это подтверждает представления Ленгмюра об ориентации молекул ПАВ в поверхностном слое. Интересно отметить, что значение S0 для тристеарина равно утроенному значению (0,66 нм2) дляСООНгруппы. Это означает, что все три карбоксильные группы занимают место в поверхностном слое.
Зная Г^, можно найти длину углеводородного радикала ПАВ, равную толщине насыщенного адсорбционного монослоя 8, т. е. высоту «молекулярного частокола». Действительно, объем одной адсорбированной молекулы — 8S0, объем адсорбированного слоя — 8SqNa, масса его М = = р8SqNa и равна молярной массе ПАВ. Здесь р — плотность ПАВ. Тогда, учитывая формулу (3.25), имеем:

Многочисленные экспериментальные проверки полученного уравнения показали хорошее согласие значений 8, вычисленных по формуле (3.26) и измеренных другими методами[1].
Теория Ленгмюра позволила раскрыть физический смысл констант А и В эмпирического уравнения Шишковского (3.23). Совмещение уравнений (3.22) и (3.24) и последующее интегрирование результата дает уравнение.
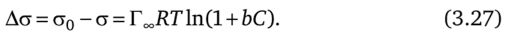
Оно аналогично уравнению Шишковского, при этом константа А = = RTTX не зависит от размера неполярной группы ПАВ, что и наблюдается в экспериментах. Константа В равна адсорбционному коэффициенту Ъ в уравнении Ленгмюра, он индивидуален для каждого вещества и определяется способностью ПАВ к адсорбции, т. е. значение В должно увеличиваться с ростом длины углеводородного радикала ПАВ, что также подтверждается опытом.
Поскольку есть уравнения, связывающие, а и С (уравнение Шишковского), Г и С (уравнение Ленгмюра) и уравнение, объединяющее а, С и Г (уравнение Гиббса), должно быть уравнение, связывающее о и Г. Такое уравнение было получено А. Фрумкиным и носит его имя:
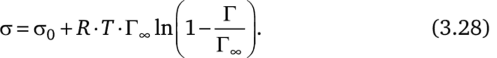
Согласно уравнению (3.28) при одинаковой адсорбции Г все гомологи уменьшают, а на одинаковую величину. Различие поверхностной активности в гомологическом ряду ПАВ обусловлено различной способностью их к адсорбции, т. е. одно и то же значение Г достигается для короткоцепочечных ПАВ при значительно больших С, чем для длинноцепочечных ПАВ. Но если концентрации у гомологов таковы, что их адсорбции одинаковы, то они понижают, а на одну и ту же величину.
Способность ПАВ снижать поверхностное натяжение воды называют поверхностной активностью. Количественно поверхностная активность характеризуется величиной (по Ребиндеру).

Данное определение g не выполняется в случае водных растворов ионогенных ПАВ: кривая зависимости, а от С в области сильно разбавленных растворов (при С —> 0) может быть даже параллельной оси абсцисс (g = О)[2].
Поверхностную активность можно определить графически по экспериментальной изотерме поверхностного натяжения о = ДС), проведя касательную к кривой в точке ее пересечения с осью ординат (при С = 0) и вычислив тангенс угла наклона касательной (рис. 3.21).
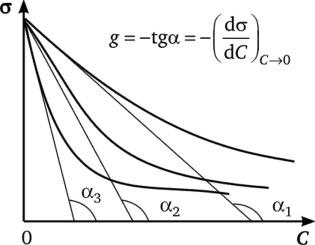
Рис. 3.21. Изотермы поверхностного натяжения растворов ПАВ одного.
гомологического ряда:
1—3 — число группСН2— в углеводородном радикале Располагая компьютером, определить g еще проще. Для этого методом наименьших квадратов определяют константы В и А уравнения Шишковского (3.23), описывающего опытные изотермы о = ДС). Далее, полученные константы подставляют в выражение производной по С уравнения Шишковского:

и рассчитывают g в любой точке кривой, в том числе и при С = 0.
Поверхностно-активные свойства ПАВ зависят от числа метиленовых группСН2— в углеводородной цепи и природы полярной группы. Э. Дюкло и И. Траубе установили эмпирическое правило (правило Дюкло — Траубе), согласно которому поверхностная активность жирных кислот, спиртов, аминов и других веществ в гомологических рядах возрастает в 3—3,5 раза при удлинении углеводородного радикала на однуСН2— группу:

где n — число метиленовых групп в углеводородном радикале. Это правило выполняется лишь для водных растворов ПАВ. Для растворов в неполярных растворителях g при увеличении длины радикала, наоборот, уменьшается (обращение правила Дюкло — Траубе).
Э. Ленгмюр дал теоретическое обоснование приведенным закономерностям. При добавлении ПАВ в воду практически не гидратирующиеся углеводородные цепи раздвигают молекулы воды, встраиваясь в ее структуру. На осуществление этого требуется совершение работы против молекулярных сил, так как взаимодействия между молекулами воды существенно интенсивнее, чем между молекулами воды и радикалами ПАВ. Обратный процесс — выход молекул ПАВ на межфазную поверхность с ориентацией углеводородных цепей в неполярную фазу газа идет самопроизвольно с уменьшением энергии Гиббса системы и выигрышем работы адсорбции. Чем длиннее углеводородный радикал, тем большее число молекул воды он разъединяет и тем больше тенденция молекул ПАВ к выходу на поверхность, т. е. тем больше их адсорбция и работа адсорбции. Работа адсорбции при удлинении цепи на одно звеноСН2— возрастает на одну и ту же величину (2,93 кДж/моль), что приводит к увеличению константы адсорбционного равновесия (адсорбционного коэффициента Ь) в одно и то же число раз (~ 3,2 раза (при 20°С)). Это, в свою очередь, приводит к возрастанию поверхностной активности в 3—3,5 раза в согласии с правилом Дюкло — Траубе.