Основные принципы реакционной способности
Химические реакции в первом приближении можно охарактеризовать как процессы, при которых происходит перераспределение электронов внешних оболочек. Направление реакции существенно зависит от распределения электронов в реагирующих молекулах. Совокупность факторов, управляющих распределением электронной плотности и возможностью образования новой, более стабильной системы, обладающей минимальной… Читать ещё >
Основные принципы реакционной способности (реферат, курсовая, диплом, контрольная)
Движущие силы органических реакций
Химические свойства атомов и молекул, выражающиеся в их способности вступать во взаимодействие друг с другом, обусловлены состоянием имеющихся в них электронов. В более простых случаях главную роль в химическом взаимодействии играют валентные электроны внешних оболочек реагирующих атомов.
Если при взаимодействии атомных орбиталей двух сближающихся атомов возникает связывающая молекулярная орбиталь, то это эквивалентно образованию химической связи и образованию устойчивой молекулы с минимумом внутренней энергии (см. гл. 1).
Химические реакции в первом приближении можно охарактеризовать как процессы, при которых происходит перераспределение электронов внешних оболочек. Направление реакции существенно зависит от распределения электронов в реагирующих молекулах. Совокупность факторов, управляющих распределением электронной плотности и возможностью образования новой, более стабильной системы, обладающей минимальной потенциальной энергией, в конечном счете обусловливает протекание химической реакции, является ее движущей силой[1].
Классификация реакций в органической химии
Органические реакции можно подразделить на четыре основных типа: 1) замещение; 2) присоединение; 3) отщепление (элиминирование); 4) перегруппировка.
Иногда сложная суммарная реакция может включать несколько типовых реакций, однако отдельные стадии суммарной реакции всегда можно отнести к одному из перечисленных типов.
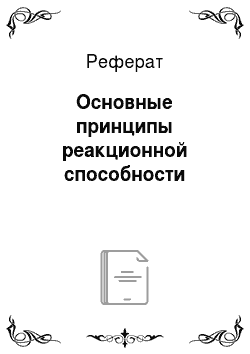
Как правило, основное органическое вещество, участвующее в реакции, называют субстратом, тогда другой компонент реакции обычно условно рассматривают как реагент.
Распределение электронной плотности в реагирующей молекуле часто определяет тип реагента, с которым основное органическое вещество (субстрат) будет реагировать. Так, в бромистом этиле углеродный атом, связанный с атомом брома и имеющий низкую электронную плотность (см. разд. 3 этой главы), будет легко подвергаться атаке частицами, несущими отрицательный заряд (NC, НО), или молекулами, в которых имеются центры с высокой электронной плотностью (:NH3, :NR3): 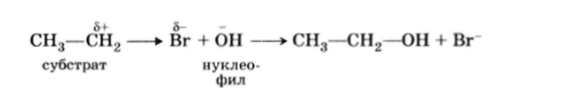
В этом случае реагент называют нуклеофильным реагентом или нуклеофилом, а реакция называется нуклеофильной реакцией.
Напротир, реагенту электронным дефицитом (чистый катион — Н*, N02, C6H5N2 или молекула, имеющая центр с низкой электронной плотностью — S03 и BF3) будет реагировать с субстратом, в котором имеются центры с высокой электронной плотностью (см. гл. 9):
Реагент такого типа называется электрофильным реагентом или электрофилом, а реакция называется электрофильной реакцией (см. также с. 221).
И электрофильные, и нуклеофильные реакции называются гетеролитическими реакциями.
Наиболее часто используются нуклеофилы: ОН, OR, RS, RCOO, Hal, CN, Н", NH2,N, /О, /S, RLi (фактически R), RMgX (R), LiAlH4(H);
электрофилы: Hf, H30~, C6H5N2, HN03 (фактически N02),.

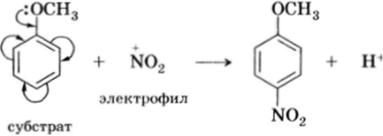
Существуют реакции, в которых реагент является радикальной частицей, несущей неспаренный электрон (см. разд. 5 этой главы). Такие реакции называются радикальными или гомолитическими реакциями. Реакции этого типа из-за очень высокой реакционной способности радикалов мало чувствительны к распределению электронной плотности в субстрате:
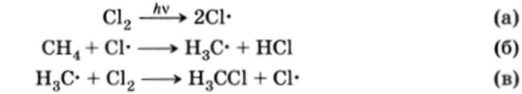
Образование хлористого метила является результатом двух последовательных радикальных реакций (б) и (в). Радикал хлора образуется при УФ-облучении молекулы хлора.
Существует не очень большой круг реакций, в результате которых изменяется порядок связей без участия радикальных или заряженных частиц. Такие реакции получили название эяектроциклических реакций (см. приложение). Они протекают при облучении или нагревании:
Надо сказать, что стремление жестко классифицировать реакции в какой-то мере консервативно. Во многих реакциях лишь условно один компонент может считаться субстратом, а второй реагентом. Довольно часто передача электронной пары от нуклеофила к электрофилу идет ступенчато через первую стадию так называемого одноэлектронного переноса.
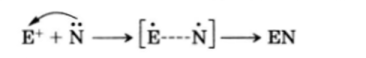
с последующей рекомбинацией радикальной пары, возникающей в переходном состоянии (см. с. 91).
Эти представления не сводят ионные процессы к радикальным и не опровергают основ гетеролитических процессов, а лишь углубляют наши представления о более тонких деталях ионных реакций.[2]
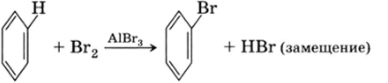
Названия типов реакций говорят сами за себя. Так, характерной реакцией замещения является превращение бензола в бромбензол, при которой происходит замещение водорода на бром:
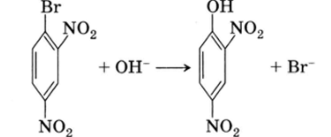
В реакциях электрофильного замещения чаще всего замещается атом водорода, в реакциях нуклеофильного замещения — какая-либо другая группа:
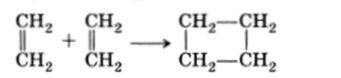
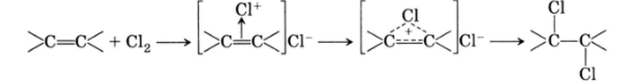
Возможно и радикальное замещение атомов водорода. Реакции присоединения к углерод-углеродной двойной связи (подробнее см. с. 170) чаще всего являются электрофильными реакциями:
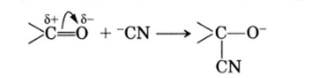
Напротив, присоединение к двойным связям /С=0 и /C=N— обычно происходит при атаке нуклеофилом:
Реакции отщепления, или элиминирования, приводящие в большинстве случаев к образованию дополнительной связи между атомами, также могут вызываться нуклеофильными или электрофильными агентами: 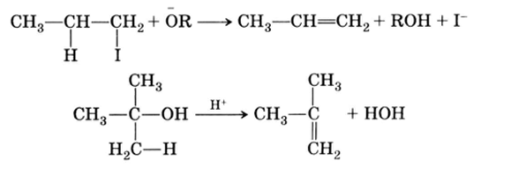
Перегруппировки подразделяются на внутримолекулярные, когда группа мигрирует в пределах реагирующей молекулы, и межмолекулярныеу когда мигрирующая группа покидает реагирующую молекулу. Перегруппировки наиболее часто вызываются электрофилами или нуклеофилами, но могут иметь и радикальный характер.
Как правило, перегруппировки сопровождаются реакциями отщепления или присоединения, что приводит к образованию более стабильного продукта.
Наблюдается внутримолекулярная пинаколиновая перегруппировка при обработке а-гликолей сильными кислотами, гликоли при этом превращаются в карбонильные соединения с миграцией радикала:
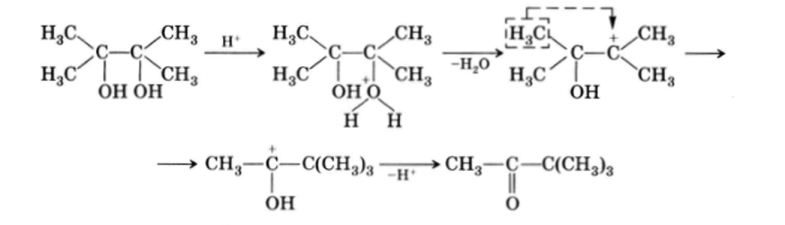
Первой стадией процесса является протонирование гидроксильной группы, после этого с отщеплением молекулы воды образуется карбкатион. Его образование доказывается проведением реакции в Н2, 80. В этом случае (если реакцию проводить не до конца) в оставшемся а-гликоле часть кислорода оказывается обмененной на , 80, что может быть только при образовании карбкатиона и его реакции с гидроксид-ионами среды. Карбкатион стабилизируется миграцией одного из радикалов от соседнего центра (устойчивость карбкатионов тем выше, чем больше заместителей у С*). Образовавшийся карбкатион с С*-центром, содержащим ОН-группу, превращается в кетон? выбросом? Н*.
Внутримолекулярная реакция Канниццаро заключается в том, что а-дикарбонильные соединения под действием щелочей превращаются в а-оксикислоты:
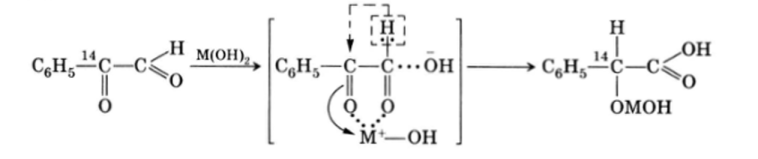
(здесь М — катион двухвалентного металла).
Внутримолекулярное перемещение гидрид-иона Н доказывается тем, что при проведении реакции в D20 в a-положении оксикислоты дейтерий не обнаруживается. Миграция Н, а не фенильной группы доказывается опытами с изотопом 14С. Внутримолекулярный механизм реакции доказывается значительным увеличением скорости перегруппировки при использовании гидроксидов двухвалентных металлов по сравнению с гидроксидами одновалентных.
Реакции подразделяются также на гетеролитические и гемолитические, в зависимости от того, разрываются ли связи? несимметрично", т. е. таким образом, что оба электрона остаются с одним из атомов, или? симметрично", так что у каждого из атомов остается по одному электрону:

Например:
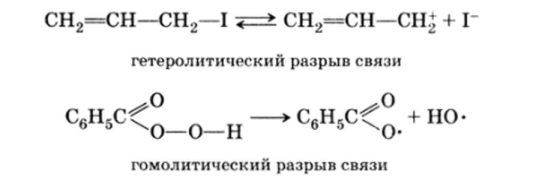
Гетеролитические реакции называют ионными реакциями, тогда как к гомолитическим процессам относят радикальные реакции.