Общие вопросы химической технологии

Рассчитайте, достаточно ли теплоты, выделяющейся при сгорании 200 кг каменного угля, содержащего 82% углерода, для полного разложения 162 кг карбоната кальция, если для разложения 1 моль СаСО3 необходимо 180 кДж теплоты, а при сгорании 1 моль углерода, входящего в состав каменного угля, выделяется 402 кДж теплоты. Если пренебречь изменением ДS0 и ДН0 с увеличением температуры, то можно определить… Читать ещё >
Общие вопросы химической технологии (реферат, курсовая, диплом, контрольная)
Термохимия
Термохимия — учение о тепловых эффектах химических реакций. Для решения задач по термохимии необходимо знать такие понятия, как тепловой эффект реакции, стандартная тепловой эффект образования вещества, стандартная тепловой эффект сгорания химического соединения, закон Гесса и следствия из него, возможность самопроизвольного протекания реакции, зависимость энергии Гиббса от температуры. Наиболее важным понятием химической энергетики является тепловой эффект химической реакции. Данные о тепловых эффектах применяются для определения строения и реакционной способности соединений, энергии межатомных и межмолекулярных связей, используются в технологических и технических расчетах. В основе термохимических расчетов по уравнениям реакций лежит закон сохранения и превращения энергии, или первое начало термодинамики. Сущность его состоит в том, что при всех превращениях энергия не возникает и не исчезает, а одни ее виды переходят в эквивалентные количества других видов. Количество выделившейся (поглощенной) теплоты в результате химической реакции называется тепловым эффектом реакции Q (при p-const QP или V-const QV) (измеряется в кДж). По тепловому эффекту химические реакции подразделяются на экзотермические (с выделением теплоты (+Q)) и эндотермические (с поглощением теплоты (-Q)). Существует величина обратная тепловому эффекту (записывается с противоположным знаком). Она характеризует внутреннюю энергию вещества и называется энтальпией (?Н). Изменение энтальпии измеряют в кДж/моль, т. е. это то количество теплоты, которое выделяется или поглощается при образовании 1 моль вещества из простых веществ. С термодинамической точки зрения принимают, что тепловой эффект при постоянном давлении и температуре равен изменению энтальпии ДН. Передачу энергии при этом рассматривают как бы со стороны самой реакционной системы. Если система отдала энергию во внешнюю среду, величина ДН считается отрицательной ДН0. Вычисление теплоты реакции по теплотам образования участвующих в ней веществ, производится на основании закона Гесса.
Закон Гесса: Тепловой эффект химической реакции при постоянном давлении и объеме не зависит от пути реакции (т.е. от промежуточных стадий), а определяется начальным и конечным состоянием системы (т.е. состоянием исходных веществ и продуктов реакции (газ, жид., тв.)).
ДrН0298 — стандартная энтальпия реакции (reaction), тепловой эффект реакции.
ДfН0298 — стандартная энтальпия образования (formation) 1 моль вещества из простых веществ в стандартных условиях (Т=298К или 25С, Р=1 атм.), на которые указывает знак «0», (кДж/моль).
ДсН0298 — стандартная энтальпия сгорания (combustion) 1 моль вещества (до образования СО2, Н2О, и др. продуктов), (кДж/моль).
Следствие 1 из закона Гесса:
Тепловой эффект химической реакции равен разности между алгебраической суммой теплот образования продуктов реакции и алгебраической суммой теплот образования исходных веществ.
ДrН0298 =?(nj *ДfН0298)прод — ?(ni* ДfН0298)исх.
где, nj и ni — количество вещества продуктов реакции и исходных веществ соответственно (численно равно коэффициенту в уравнении реакции), (моль).
Следствие 2 из закона Гесса:
Тепловой эффект химической реакции равен сумме теплот сгорания исходных веществ минус сумма теплот сгорания продуктов реакции.
ДrН0298 =?(ni* ДсН0298) — ?(nj* ДсН0298).
где, ni и nj — количество вещества исходных веществ и продуктов реакции соответственно (численно равно коэффициенту в уравнении реакции), (моль).
В химических реакциях может одновременно изменяется и энергия системы и ее энтропия, поэтому реакция протекает в том направлении, в котором общая суммарная движущая сила реакции уменьшается. Если реакция происходит при постоянном температуре и давлении, то общая движущая сила реакции называется энергией Гиббса (ДG0) и направление реакции определяется ее изменением.
Зависимость энергии Гиббса реакции от температуры описывается уравнением ДG0T=ДH0T — TДS0T.
При стандартной температуре ДG0298=ДH 0298- TДS0298.
ДG0298 — стандартная энергия Гиббса, изменение энергии Гиббса при образовании 1 моль вещества из простых веществ в стандартных условиях, (кДж/моль).
Стандартную энергию Гиббса реакции рассчитывают по первому следствию из закона Гесса.
?rG 0298= ?(njДfG0298) прод. -? (niДfG0298)исход.
ДS0298 — стандартная энтропия 1 моль вещества в стандартном условиях, (Дж/К*моль). Энтропию можно характеризовать как меру беспорядка (неупорядоченности) системы. Эта величина характеризует изменение температуры в системе.
Поскольку энтропия — функция состояния системы, ее изменение (ДS) в процессе химической реакции можно подсчитать, используя следствие из закона Гесса.
ДrS0298 =? (njДfS0298) прод. —?(niДfS0298)исход
где, nj и ni — количество вещества продуктов реакции и исходных веществ соответственно (численно равно коэффициенту в уравнении реакции), (моль).
ДrS0298 =? (niДfS0298) исход —?(njДfS0298)прод
где, ni и nj — количество вещества исходных веществ и продуктов реакции соответственно (численно равно коэффициенту в уравнении реакции), (моль).
ДrS0298 — стандартная энтропия реакции, (Дж/К).
ДfS0298 — стандартная энтропия образования химического вещества, (Дж/К*моль).
Знак «- «перед членом TДS0298 (энтропийным членом) ставится, для того чтобы при ДH=0 сделать? G отрицательной величиной ДG<0 — условие самопроизвольного протекания реакции.
Если пренебречь изменением ДS0 и ДН0 с увеличением температуры, то можно определить Травн, т. е. температуру, при которой устанавливается химическое равновесие химической реакции для стандартного состояния реагентов, т. е. из условия равновесия реакции ДG=0 имеем 0=ДrH 0298— TДrS 0298, отсюда
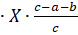
Следует знать:
Если ДS=0 (ДS>0), ДH<0(ДH=0) то ДG <0 — реакция протекает самопроизвольно, процесс протекает в прямом направлении (энергетически выгоден).
Если ДS=0(ДS0 (ДH=0) то ДG>0 — протекание реакции невозможна, возможна только в обратном направлении (энергетически невыгоден).
Если ДS=0, ДH=0 ДG=0 — система находится в состоянии равновесия.
Примеры решения задач.
1. Вычислить тепловой эффект реакции получения гидроксида кальция
СаО(т) + Н2О(ж) = Са (ОН)2(т), если теплота образование СаО(т) равна +635 701,5Дж/моль, теплота образования Н2О(ж) +285 835,5 Дж/моль и теплота образования Са (ОН)2 +986 823 Дж/моль.
Решение:
Тепловой эффект реакции.
СаО (т) + Н2О (ж) = Са (ОН)2(т) по первому следствию закона Гесса, будет равен теплоте образования Са (ОН)2(т) минус теплота образования Н2О(ж) и теплота образования (СаО(т)):
ДrН0298 =?(nj *ДfН0298)прод — ?(ni* ДfН0298)исх.
ДrН0298=1 моль*ДfН0298(Са (ОН)2(т)) — (1 моль ДfН0298(СаО(т)) +.
+1 моль* ДfН0298(Н2О (ж)))=1 моль*986 823 Дж/моль — (1 моль* 635 701,5 Дж/моль +.
+ 1 моль*285 835,5 Дж/моль)= 65 286 Дж.
Ответ: 65 286 Дж.
2. Вычислите изменения энергии Гиббса в реакции димеризации диоксида азота при стандартной температуре, при 0 и 100єС. Сделать вывод о направлении процесса.
Решение:
При стандартной температуре 298 К изменение энтальпии в реакции.
2NO2 (г) N2O4(г) равно (первое следствие закона Гесса) ДrН0298 =?(nj *ДfН0298)прод — ?(ni* ДfН0298)исх.
Д rН0298 =1 моль* 9660 Дж/моль — 2 моль*33 800 Дж/ моль = - 57 940 Дж.
Изменение температуры равно.
ДrS0298 =? (nДfS0298) прод. -?(nДfS0298)исход = 1 моль*304 Дж/моль*К ;
— 2 моль*234 Дж/моль*К = - 164 Дж/К Зависимость энергии Гиббса реакции от температуры описывается уравнением ДG0T =ДH0T — TДS0T
При стандартной температуре ДrG0298=ДH 0298— TДS0298 = - 57 940 Дж — (298 К*(-164 Дж/К)) = -9068 Дж/моль Отрицательное значение энергии Гиббса реакции говорит о том, что смещении равновесия вправо (самопроизвольный процесс), т. е. в сторону образования диоксида азота.
При 0єС (273К) ДrG0273 = -57 940 Дж + 273К* 164 Дж/К = -13 168 Дж/моль Более высокое отрицательное значение ДG273 по сравнению с ДG0298 свидетельствует о том, что при 273 К равновесие еще больше смещено в сторону прямой реакции.
При 100єС (373 К) ДrG373 = -57 940 Дж + 373К*164 Дж/К = 3232 Дж/моль.
Положительная величина ДG373 указывает на изменение направления реакции: равновесие смещено влево, т. е. в сторону распада димера N2O4 (реакция невозможна). Ответ: при 0єС (273 К) ДrG273= -13 168 Дж/моль, реакция протекает самопроизвольно; при 100єС (373 К) ДrG373= 3232 Дж/моль, реакция невозможна.
3. Составьте термохимическое уравнение горения метана СН4 и рассчитайте объем воздуха, необходимый для сжигания 1моль метана, если известно, что при сгорании 5,6 л метана выделяется 220 кДж теплоты, содержание кислорода в воздухе равно 20%.
Решение:
СН4 + 2О2 = СО2 + 2Н2О, ?Н<0.
Находим количество вещества метана объемом 5,6 л.
Если при сгорании СН4 количеством вещества 0,25 моль выделяется 220 кДж теплоты, то при сгорании СН4 количеством вещества 1 моль выделяется 880 кДж теплоты.
Термохимическое уравнение:
СН4 +2О2 = СО2+ 2Н2О+ 880 кДж Из уравнения реакции видно, что на сгорание СН4 количеством вещества 1моль расходуется О2 количеством вещества 2 моль, на сгорание СН4 количеством вещества 0,25 моль расходуется х моль О2, откуда х = 0,5 моль.
Кислород количеством вещества 0,5 моль занимает объем 11,2 л.
В воздухе 20% кислорода, следовательно, объем воздуха будет равен.
Ответ: 880 кДж, 56 л.
Задачи для самостоятельного решения.
- 1. Рассчитайте, какая из ниже перечисленных реакций при стандартных условиях может идти самопроизвольно:
- а) Fe(к) + Al2O3(к) = Al(к) + Fe2O3(к)
- б) Al(к) + Fe2O3 (к)= Fe(к) + Al2O3(к)
- в) CuSO4(к) + 2NH4OH(ж) = Cu (OH)2(к) + (NH4)2SO4(к)
- г) Al2O3(корунд) + 3SO3 = Al2(SO4)2(к)
- 2. При сварке трамвайных рельсов используют термитную смесь, которую готовят, смешивая порошки алюминия и оксида железа (III) в количественном отношении 2:1. Термохимическое уравнение горения термитной смеси следующее: 2Al + Fe2O3= Al2O3 + 2Fe + 829,62 кДж. Сколько теплоты выделится при образовании: 1) 4 моль железа; 2) 1 моль железа?
- 3. Рассчитайте, достаточно ли теплоты, выделяющейся при сгорании 200 кг каменного угля, содержащего 82% углерода, для полного разложения 162 кг карбоната кальция, если для разложения 1 моль СаСО3 необходимо 180 кДж теплоты, а при сгорании 1 моль углерода, входящего в состав каменного угля, выделяется 402 кДж теплоты.
- 4. Процесс алюминотермии выражается химическим уравнением
- 8Al + 3 Fe3O4 = 4Al2O3 + 9Fe ДH<0.
Рассчитайте, сколько теплоты выделится при сгорании 1 кг термита.
- 5. Возможен ли обжиг колчедана массой 1 т по следующему уравнению химической реакции
- 4FeS2 + 11O2 >2 Fe2O3 + 8SO2 ?H<0
- 6. Вычислите тепловой эффект образования NH3 из простых веществ, при стандартном условии по тепловым эффектам реакции:
- 2H2 + O2 = 2H2O(ж) ДН01 = -571, 68 кДж,
NH3 + 3O2 = 6H2O(ж) + 2N2 ДН02 = -1530,28 кДж.
7. Стандартный тепловой эффект реакции сгорания этана равен -1560 кДж. Рассчитайте стандартную теплоту образования этана, если известно, что.
ДfН0298 (H2O)= -285,84 кДж/моль и ДfН0298(СО2) = -396,3 кДж/моль.
8. Вычислите тепловой эффект реакции восстановления оксида железа водородом, пользуясь следующими данными.
FeO + CO = Fe + CO2 ДН = -13,19 кДж.
CO + ½O2 = CO2 ДН = -283,2 кДж.
- 2H2 + ½O2 = 2H2O(г) ДН = -242 кДж
- 9. Протекание, какой из приведенных реакций восстановления оксида железа (III) наиболее вероятно при 298 К.
Fe2O3(k) + 3H2(г) = 2Fe(к) + 3H2O(к)
Fe2O3(k) + 3С(графит) = 2Fe(к) + 3СO(к)
Fe2O3(k) + 3СО(г) = 2Fe(к) + 3СО2(к)
- 10. В какой их перечисленных ниже реакций тепловой эффект ДН0298 будет стандартной теплотой SO3(г)
- а) S(г) + 3/2 O2 = SO3(г)
- а) S(г) + ½ O2 = SO3(г)
- а) S(к) + 3/2 O2 = SO3(г)