Термодинамика биологических систем

Термодинамический процесс — переход системы из одного состояния с параметрами Р1, 1, T1 в другое с параметрами Р2, 2, T2. Обратным называется процесс, в результате совершения которого и возвращения системы в исходное состояние в окружающей среде не остается никаких изменений. Внутренняя энергия системы изменяется при передаче теплоты или совершении работы. Внутренняя энергия равна сумме… Читать ещё >
Термодинамика биологических систем (реферат, курсовая, диплом, контрольная)
Термодинамика
Термодинамика — раздел физики, изучающий закономерности тепловой формы движения материи и связанных с ней физических явлений.
Термодинамическая система — тело и совокупность тел, которые могут обмениваться между собой и с внешней средой веществом и энергией. Открытая термодинамическая система обменивается с окружающей средой и энергией и веществом.
Закрытая термодинамическая система обменивается с окружающей средой только энергией.
Изолированная термодинамическая система не обменивается с окружающей средой ни энергией, ни веществом.
Если параметры системы при взаимодействии ее с окружающими телами не изменяются с течением времени, то состояние системы называется стационарным. Примеры: состояние тела человека, состояние внутренней части работающего холодильника, состояние воздуха в отапливаемом помещении.
Изолированная термодинамическая система с течением времени приходит в равновесное состояние (термодинамическое равновесие), в котором температура всех макроскопических частей системы одинакова. Время прихода системы в равновесие называется временем релаксации.
Термодинамические параметры: температура (Т), давление (Р), объем () — микроскопические величины, поддающиеся измерению.
Уравнение состояния системы: f (P1, 1, T1) = 0 дает связь между термодинамическими параметрами.
Термодинамический процесс — переход системы из одного состояния с параметрами Р1, 1, T1 в другое с параметрами Р2, 2, T2. Обратным называется процесс, в результате совершения которого и возвращения системы в исходное состояние в окружающей среде не остается никаких изменений. Внутренняя энергия системы изменяется при передаче теплоты или совершении работы. Внутренняя энергия равна сумме кинетической и потенциальной энергии взаимодействия всех частиц системы.
Первое начало термодинамики представляет собой закон сохранения энергии: количество тепловой энергии, подведенное к системе, расходуется на изменение внутренней энергии системы и на работу, которая производится этой системой:
Q = U + A.
В дифференциальном виде: dQ = dU + dA.
Работа газа в изопроцессах (А):
При изотермическом расширении молей газа А=RTln (V2/V1), где R — универсальная газовая постоянная, Т — термодинамическая температура, V2 и V1 — конечный и начальный объемы газов.
При изобарическом расширении газа.
А= Р (V2 — V1),.
где Р — давление газа.
Величина С, равная отношению переданной системе теплоты Q к изменению ее температуры Т, называется теплоемкостью системы в данном процессе:
С = Q/.
Единица теплоемкости в СИ — джоуль на кельвин (ДЖ / К). Теплоемкость одного моля вещества называется молярной См = с/. Единица молярной теплоемкости в СИ — джоуль на моль кельвин — Дж/(мольК). Отношение теплоемкости к массе вещества есть удельная теплоемкость Суд = с/m. Единица удельной теплоемкости в СИ — джоуль на килограмм-кельвин — Дж/(кгК).
Различают молярную теплоемкость при постоянном объеме газа © и молярную теплоемкость при постоянном давлении — Ср.
С = iR/2,.
где i — число степеней свободы.
Ср = Сv + R = ;
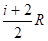
уравнение Майера.
Коэффициент адиабаты:
= Ср/ Сv= (i + 2)/i.
Процесс, происходящий при отсутствии теплообмена между системой и окружающей средой, называется адиабатическим. Первое начало термодинамики для адиабатического процесса: dA = - dU. Работа при адиабатическом процессе:
А = Сv (Т1 — Т2) = Сv Т.
Уравнение Пуассона для адиабатического процесса: рvг = const.
Примеры адиабатических процессов: быстрое расширение (сжатие) горючей смеси в цилиндре двигателя внутреннего сгорания.
Круговым процессом или циклом называется процесс, в результате которого система, пройдя через ряд состояний, возвращается в исходное состояние.
Если в результате цикла совершается некоторая работа, то система, периодически повторяющая такой цикл, называется тепловой машиной.
Идеальная тепловая машина (цикл Карно) состоит из газа (рабочее тело), заключенного в цилиндр под поршнем, нагревателя и охладителя (холодильника). Система совершает обратимые циклы, состоящие из двух изотермических (I 2 и 3 4) и двух адиабатических (2 3 и 4 1).
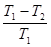
КПД цикла Карно: = = .
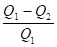
Здесь Т1 — температура нагревателя, Т2 — холодильника (охладителя) Q1 — количество теплоты, полученное от нагревателя, Q2 — переданное холодильнику (охладителю).
Тепловые машины находят применение в сельском хозяйстве: танки для охлаждения молока, холодильные камеры, камеры хранения мясных туш и пр.
Формулировки второго начала термодинамики.
Невозможен процесс, единственным результатом которого является превращение всей теплоты, полученной от нагревателя в работу.
Вечный двигатель второго рода невозможен (Гипотетический механизм, превращающий всю теплоту в работу).
Невозможен процесс, при котором теплота самопроизвольно переходила бы от менее нагретого к более нагретым.
Энтропия замкнутой системы не убывает: S0.
Энтропия S есть мера необратимого рассеяния энергии, она представляет собой функцию состояния термодинамической системы.
В изотермическом процессе изменение энтропии равно отношению сообщенного системе количества теплоты Q к температуре Т:
- S = Q/Т
- 5. Для обратимых процессов в изолированной системе энтропия остается постоянной, а для необратимых — возрастает, т. е. S0. Это неравенство Клаузиуса называют законом неубывания энтропии.
Живой организм есть открытая термодинамическая система. Энергетический баланс организма находится в полном соответствии с законом сохранения энергии.
Превращение энергии в живых организмах:
Химическая в механическую — в мышечных тканях.
Химическая в электрическую — во всех клетках.
Химическая в световую — в светящихся тканях у рыб и насекомых.
Световая в химическую — в фоторецепторах сетчатки глаза, в клетках кожи, в листьях растений (фотосинтез).
Механическая акустических волн в электрическую — в органе Корти во внутреннем ухе.
Все виды энергии в тепловую — во всех клетках и тканях.
Живой организм имеет некоторое сходство с тепловой машиной: он так же выделяет теплоту в окружающую среду, т. е. обладает свойством теплопродукции за счет энергии, полученной от пищи и кроме того, выполняет различные виды работы: механическую, электрическую, химическую, осмотическую. Так же, как в тепловой машине, в организме происходит выделение энергии при сгорании, т. е. при окислении топлива, в живом организме энергия выделяется при окислении пищевых продуктов — белков, жиров и углеводов. Аккумулирование энергии в живом организме происходит в сложных биохимических соединениях, важнейшим из которых является аденозинтрифосфатная кислота (АТФ). В молекуле АТФ наряду с обычными связями имеются и макроэргические между составными ее частями (Макроэргические — обладающие большей энергией). В результате реакции из АТФ образуется АДФ (аденозиндифосфат), при разрыве макроэргической связи выделяется энергия от 25 до 33 кДж/моль.
8.9 Благодаря саморегулируемой теплопродукции, температура тела у теплокровных животных остается постоянной и не зависит от температуры внешней среды. Для поддержания стационарного температурного состояния живые организмы в ходе эволюции выработали определенные механизмы, которые позволяют увеличивать или уменьшать теплообмен с внешней средой. Так, при охлаждении животного в его клетках увеличивается скорость гидролиза АТФ и в мышцы поступает дополнительная энергия, внешний признак — у животных взъерошиваются волосы (у человека — гусиная кожа). При повышении температуры среды — расширение кровеносных сосудов, увеличение потоотделения, учащение дыхания.
Наибольшая роль в установлении (в выравнивании) температуры тела животного принадлежит крови. Перенос тепла потоком крови аналогичен процессам в любом теплообменнике. Кровь выталкивается из левого желудочка сердца (двигатель), проходит через «нагреватель» (ткани), через «радиатор» (поверхностные части тела, легкие), отдающие теплоту во внешнюю среду, и поступает обратно в сердце, в его правый желудочек. Существуют четыре механизма, определяющие тепловое равновесие в организме: теплопроводность, конвекция, тепловое излучение, испарение. Суточный тепловой баланс человека (в покое):
Приход энергии. | кДж. | Расход энергии. | кДж. | |
Белок (56,8 г). | Выделения теплоты (общие). | |||
с выделенными газами. | ||||
Жиры (14,0 г). | С калом и мочой. | |||
Теплота испарения при дыхании. | ||||
Углеводы (79,9 г). | Теплота испарений через кожу. | |||
Различные поправки. | ||||
Всего. | ||||
Живые организмы получают теплоту в результате происходящих в них экзотермических реакций, в которых участвуют биологические макромолекулы. Как и любой тепловой двигатель, живой организм выделяет теплоту и совершает работу: Q = Qnom+А.
Это 1-ое начало термодинамики, как уравнение энергетического баланса для живого организма. Здесь: Q — количество теплоты, выделяемое в организме при усвоении пищи, Qпот — потери тепла в окружающую среду, А — совершаемая организмом работа.
При этом изменение внутренней энергии для животного организма за определенный (не короткий) промежуток времени равно нулю: U = 0, КПД организма: = А/Q.
Существенно видоизменяется 2-ое начало термодинамики для живого организма.
Полное изменение энтропии в живых организмах (S) складывается из изменения энтропии в результате ее возрастания при протекании в организме необратимых процессов (Si) и изменения энтропии (Sе), происходящего при взаимодействии между организмом и внешней средой, в результате чего в организм поступает энергия. Тогда.
S = Si + Sе.
Стационарное состояние биологической системы будет поддерживаться при условии S = 0, или Si = - Sе. Величиной, характеризующей состояние системы, служит скорость изменения суммарной энтропии:
.
Это выражение второго начала термодинамики для живых организмов (уравнение Пригожина). Скорость изменения энтропии в организме равна алгебраической сумме скорости производства энтропии внутри организма и скорости поступления энтропии из среды в организм.
В стационарном состоянии скорость изменения суммарной энтропии равна нулю :
По теореме Пригожина, в устойчивом стационарном состоянии скорость возрастания энтропии, обусловленная протеканием необратимых процессов, имеет положительное и минимальное из возможных значение: .