Ульфатометрия.
Аналитическая химия в 2 книгах.
Книга 1. Химические методы анализа

Из рассмотренного примера следует, что чем больше концентрация хромат-ионов в КТТ, тем ниже концентрация катионов серебра и, следовательно, меньше относительная индикаторная ошибка X. Однако слишком высокую концентрацию индикатора создавать не следует, так как высокая интенсивная собственная желтая окраска хромат-ионов будет затруднять фиксацию момента начала образования красного осадка хромата… Читать ещё >
Ульфатометрия. Аналитическая химия в 2 книгах. Книга 1. Химические методы анализа (реферат, курсовая, диплом, контрольная)
Сущность метода. Сульфатометрия, или сульфатометрическое титрование, — метод определения катионов бария Ва2+ путем титрования анализируемого раствора стандартным раствором серной кислоты. В основе метода лежит реакция осаждения катионов бария в виде малорастворимого осадка сульфата бария (ПР = 1,08 • 10-10):
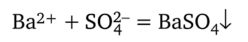
Окончание титрования фиксируют индикаторным методом.
Титранты метода. Титрантами служат стандартные растворы серной кислоты (обычно концентрацией 0,05 моль/л). Раствор серной кислоты готовят и стандартизируют так же, как и в методе кислотноосновного титрования.
Индикаторы метода. Применяют металлохромные индикаторы из группы азокрасителей — нитрохромазо (нитроортоаниловый С) и ортоаниловый А. Эти индикаторы (H2/nd) в растворе окрашены в розовый цвет, а их комплексы с катионами бария — в фиолетовый.
При титровании растворов, содержащих катионы бария, раствором серной кислоты первоначальная фиолетовая окраска раствора, обусловленная присутствием комплексов бария с индикатором, вблизи ТЭ переходит в розовую вследствие разрушения комплексов при их взаимодействии с титрантом — серной кислотой:
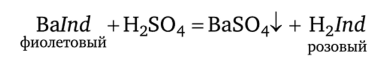
Способ проведения титрования. Катионы бария определяют прямым титрованием анализируемого раствора, содержащего эти катионы, стандартным раствором серной кислоты в присутствии индикаторов. Можно определять также серную кислоту и сульфаты, титруя анализируемый раствор, содержащий сульфат-ионы, стандартным раствором соли бария до изменения окраски раствора из розовой в фиолетовую. В таком случае метод называется бариметрия.
Преимущества метода. Использование данного метода для определения бария и сульфатов вместо гораздо более трудоемкого и продолжительного классического гравиметрического метода ускоряет и упрощает проведение анализа. В агрохимическом анализе применяют для определения сульфатов в воде, почвенных вытяжках и удобрениях.
Индикаторные ошибки осадительного титрования
Систематические ошибки осадительного титрования обусловлены двумя факторами: 1) растворимостью осадка, образующегося при взаимодействии титранта с определяемым ионом, вследствие чего некоторое количество осаждаемых определяемых ионов остается в растворе; 2) индикаторной ошибкой, вызванной присутствием в КТТ избыточного количества титрантаосадителя в результате некоторого перетитровывания раствора, так как часть титранта расходуется на взаимодействие с индикатором после ТЭ.
Ошибки, связанные с растворимостью осадка в ТЭ, можно учесть, зная произведение растворимости этого осадка. В осадительном титровании используют только такие реакции осаждения, в которых определяемые ионы переходят в ТЭ в осадок не менее чем на 99,99%, т. е. ошибка титрования, обусловленная растворимостью осадка, не должна превышать 0,01%.
Перерасход титранта за счет его взаимодействия с индикатором на практике учитывают, проводя холостое титрование раствора того же объема, что и анализируемый, содержащего в том же количестве индикатор и суспензию инертного вещества, например карбоната кальция (имитация осадка), но не содержащего осаждаемые определяемые ионы.
Проведем количественную оценку индикаторной ошибки осадительного титрования. Пусть тг — стехиометрическое количество титранта, израсходованное на титрование определяемых ионов в ТЭ; Ап — избыточное (по сравнению со стехиометрическим) количество титранта в КТТ. Тогда относительная индикаторная ошибка X осадительного титрования будет равна (%):

Таким образом, в данном случае индикаторная ошибка X осадительного титрования определяется как доля (в процентах) избыточного титранта от его стехиометрического количества. Очевидно, что.
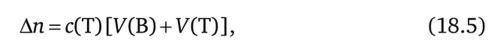
где с (Т) — концентрация титранта в титруемом растворе в КТТ, моль/л; У (В) — исходный объем анализируемого раствора; У (Т) — общий объем прибавленного титранта.
В расчетах принимается, что объем прибавленного титранта в ТЭ и в КТТ — один и тот же и равен У (Т). В данном случае это допущение не приводит к заметной ошибке расчета в силу незначительности различия объемов титранта в ТЭ и в КТТ. Тогда п = с'(Т) / У (Т), где с'(Т) — концентрация исходного раствора титранта, моль/л.
Окончательно для расчета X получаем.
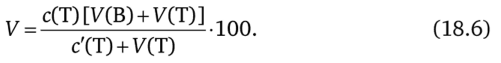
Концентрацию с'(Т) активного вещества титранта можно вычислить с учетом известной концентрации и природы индикатора.
В случае осадительного индикатора величину с (Т) рассчитывают исходя из произведения растворимости осадка, образуемого индикатором с титрантом. Так, при использовании аргентометрического метода Мора в титруемый раствор вводят в качестве индикатора хромат калия К2Сг04, который после ТЭ образует с нитратом серебра AgN03 красный осадок хромата серебра Ag2Cr04. Концентрацию [Ag+] (избыточного титранта) в КТТ можно рассчитать из величины произведения растворимости хромата серебра:

Зная концентрацию хромат-ионов в титруемом растворе, можно вычислить концентрацию [Ag+] и, подставив числовое значение [Ag+] вместо с (Т) в формулу (18.6), найти величину относительной индикаторной ошибки осадительного титрования.
Из рассмотренного примера следует, что чем больше концентрация хромат-ионов в КТТ, тем ниже концентрация [Ag+] катионов серебра и, следовательно, меньше относительная индикаторная ошибка X. Однако слишком высокую концентрацию индикатора создавать не следует, так как высокая интенсивная собственная желтая окраска хромат-ионов будет затруднять фиксацию момента начала образования красного осадка хромата серебра.
Решение. При титровании протекает реакция.
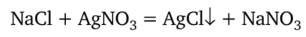
После того как прореагируют все хлорид-ионы, избыточный титрант образует с индикатором (хроматом калия) красный осадок хромата серебра:
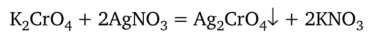
В этот момент титрование заканчивают.
Относительная ошибка осадительного титрованиях в данном случае обусловлена избыточным количеством титранта Ап, перерасходованного в КТТ, по сравнению с требуемым стехиометрическим количеством п, необходимым для осаждения хлорид-ионов:
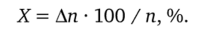
Очевидно, что n = c (AgN03) • V (AgN03) = 0,05 • 0,02 = 0,0010 моль/л.
Полагая, что объем израсходованного титранта в КТТ равен его объему в ТЭ, имеем.

где с — концентрация титранта — нитрата серебра — в КТТ, равная концентрации катионов серебра, которую находим из произведения растворимости хромата серебра:

Концентрация хромат-ионов равна концентрации хромата калия [СгО^-] = = 10-3 моль/л, следовательно,.
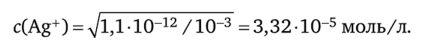
Теперь находим индикаторную ошибку X:
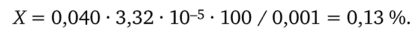
Таким образом, перерасход титранта по сравнению со стехиометрическим составляет 0,13%.