Значение окислительно-восстановительного титрования в сельскохозяйственном анализе

В агрохимии, селекции, зоотехнии, ветеринарии окислительно-восстановительное титрование применяется для определения плодородия и биологической активности почв, основных биокомпонентов в растениях и кормах (жиры, витамины, ферменты), биохимическом анализе. Данные этих анализов позволяют оценить агрохимические свойства и плодородие почв, влияние различных агротехнологий на их ферментативную… Читать ещё >
Значение окислительно-восстановительного титрования в сельскохозяйственном анализе (реферат, курсовая, диплом, контрольная)
В агрохимии, селекции, зоотехнии, ветеринарии окислительно-восстановительное титрование применяется для определения плодородия и биологической активности почв, основных биокомпонентов в растениях и кормах (жиры, витамины, ферменты), биохимическом анализе.
Например:
- • содержание гумуса в почве определяют методом обратного дихроматометрического титрования, используя в качестве титранта соль Мора (метод И. В. Тюрина);
- • активность окислительно-восстановительного фермента каталозы определяют методом перманганатометрического титрования, аскорбинатоксидазы — с использованием иодатометрии;
- • содержание непредельных жирных кислот (йодное число) в растительном материале — методом иодометрии.
Данные этих анализов позволяют оценить агрохимические свойства и плодородие почв, влияние различных агротехнологий на их ферментативную активность; накопление витаминов, непредельных жирных кислот в кормах растительной и животноводческой продукции.
Контрольные вопросы и задания
- 1. Как изменяется степень окисления элементов при окислении и восстановлении?
- 2. Приведите примеры типичных окислителей и восстановителей.
- 3. Какое значение имеют редокс-потенциалы для управления реакциями окисления — восстановления?
- 4. Пользуясь ионно-электронным методом, подберите коэффициенты в уравнениях, протекающих по схемам:
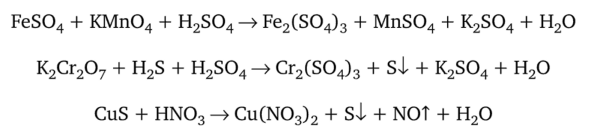
5. Чему равны молярные массы эквивалентов окислителей и восстановителей в следующих реакциях:
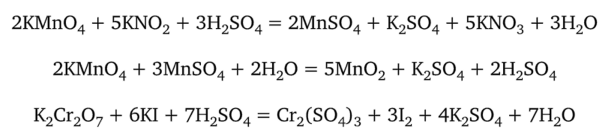
6. Навеску КМп04 1,8750 г растворили и довели объем раствора водой до 500 мл. Вычислите молярную концентрацию эквивалентов КМп04 в растворе для реакции: а) в кислой среде; б) в щелочной среде.
Ответ: а) 0,1187 н.; б) 0,7 122 н.
7. Навеску технического железного купороса 5,77 г растворили и довели объем раствора водой до 250 мл. На титрование 25,00 мл раствора пошло в среднем 19,34 мл раствора КМп04 с титром 0,0031 г/мл. Вычислите массовую долю (%) FeS04 в техническом продукте.
Ответ: 50,0%.
8. К 20,00 мл раствора хлорида кальция прилили избыток раствора оксалата аммония, полученный осадок отфильтровали, промыли и обработали разбавленной серной кислотой: СаС204 + H2S04 = CaS04xl + Н2С204.
Освободившуюся при этом щавелевую кислоту оттитровали 24,50 мл ОД н. раствора КМп04. Вычислите титр и молярную концентрацию эквивалентов раствора СаС12.
Ответ: 0,1 359 г/мл и 0,1225 н.
- 9. На чем основано дихроматометрическое титрование восстановителей?
- 10. Чему равна молярная масса эквивалентов дихромата калия при взаимодействии его с железом (II)?
- 11. В чем преимущества и недостатки дихромата калия перед перманганатом калия?
- 12. Что такое редокс-индикаторы? Правила выбора их для ОВ-титрования.
- 13. Как проводят дихроматометрическое определение железа (Н)? Какой индикатор при этом используется? Зачем к раствору прибавляют ортофосфорную кислоту?
- 14. Найдите массу навески дихромата калия для приготовления 250 мл 0,05 н. раствора.
Ответ: 0,6129 г.
15. При анализе оксида железа неизвестного состава для приготовления 20 мл раствора взята навеска его 0,1000 г. Все железо было восстановлено до Fe2+ и затем оттитровано 0,0993 н. раствором К2Сг207, которого израсходовано при этом 13,05 мл. Найдите массу железа и массовую долю его в оксиде.
Ответ: 0,7 237; 72,37%.
- 16. На чем основано иодометрическое определение восстановителей, окислителей и кислот?
- 17. Чему равна молярная масса эквивалентов тиосульфата натрия в реакции взаимодействия его с иодом?
- 18. Перечислите условия, соблюдение которых обязательно при иодометрическом титровании.
- 19. К 25,00 мл раствора H2S прибавили 50,00 мл 0,1 960 н. раствора иода. На последующее титрование избытка 12, не вошедшего в реакцию, пошло 11,00 мл 0,2 040 н. раствора Na2S203-5H20. Сколько граммов H2S содержится в 1 л анализируемого раствора?
Отпет: 0,5150 г.
20. Для определения меди (П) методом косвенного титрования из 100 мл анализируемого раствора соли меди взяли 15 мл, прибавили раствор H2S04 и избыток раствора иодида калия. Выделившийся иод оттитровали 6 мл стандартного раствора Na2S20, концентрацией 0,05 моль/л. Рассчитайте молярную концентрацию эквивалентов, титр и массу меди (П) в анализируемом растворе.
Ответ: 0,0200 моль/л; 0,1 271 г/мл; 0,1271 г.