Диаграммы состояния металлов и сплавов

Превращение в сплавах системы Fe — C. Диаграмма состояния Fe — Fe3C характеризует фазовый состав и превращения в системе железо — цементит (6,67%С). Особенность диаграммы — наличие на оси составов двух шкал, показывающих содержание углерода и цементита. Превращение в сплавах системы Fe — Fe3C происходит как при затвердевании жидкой фазы, так и в твёрдом состоянии. Первичная кристаллизация идёт… Читать ещё >
Диаграммы состояния металлов и сплавов (реферат, курсовая, диплом, контрольная)
1. Диаграммы состояния
Сплавы состоят из двух и более элементов периодической системы. Элементы образующие сплавы, называют компонентами. Свойства сплава зависят от многих факторов, но прежде всего они определяются составом фаз и их количественным соотношением. Эти сведения можно получить из анализа диаграмм состояния. Зная диаграмму состояния, можно представить полную картину:
формирования структуры любого сплава;
определить оптимальную температуру заливки сплава для получения литых деталей;
оценить жидкотекучесть выбранного сплава и возможность получения химической неоднородности;
сделать заключение о возможности и условиях обработки давлением;
определить режим термической обработки, необходимый для данного сплава.
Методы построения диаграмм состояния.
Диаграммы состояния строят в координатах температура — химический состав сплава. Таким образом, диаграмма состояния представляет собой графическое изображение фазового состава сплавов данной системы в функции температуры и химического состава сплава. Экспериментально построенные диаграммы состояния проверяют по правилу фаз, дающему возможность теоретически обосновать направление протекания процессов превращения для установления равновесного состояния системы. Общие закономерности существования устойчивых фаз, отвечающих условиям равновесия, могут быть выражены в математической форме, называемой правилом фаз (Гиббса). Правило фаз даёт возможность:
предсказать и проверить процессы, происходящие в сплавах при нагреве и охлаждении;
оно показывает, происходит ли процесс кристаллизации при постоянной температуре или в интервале температур;
указывает, какое число фаз может одновременно существовать в системе.
Так как диаграммы состояния обычно строятся при постоянном (атмосферном) давлении, то правило фаз выражается следующим уравнением:
С = К + 1 — Ф где К — число компонентов в системе; Ф — число фаз; С — число степеней свободы (или вариантность системы).
Число степеней свободы — это число независимых переменных внутренних (состав фаз) и внешних (температура, давление) факторов, которые можно изменять без изменения числа фаз, находящихся в равновесии. Известно, что в равновесном состоянии могут быть только те составы фаз в системе, которые имеют минимальную свободную энергию (термодинамический потенциал) при данной температуре. Если в двойной системе насчитываем число фаз больше трёх, это значит, что сплав не находится в равновесном состоянии или неправильно определено число фаз или компонентов. Для однофазного состояния правило фаз не применяют. Диаграмма состояния сплавов, компоненты которых полностью растворимы в жидком и твёрдом состоянии.
Имея диаграмму состояния, можно проследить за фазовыми превращениями любого сплава и указать состав и количественное соотношение фаз при любой температуре. Это осуществляется при помощи двух простых правил:
Правило концентраций — правила определения состава фаз;
Правило отрезков — правило определения количественного определения фаз.
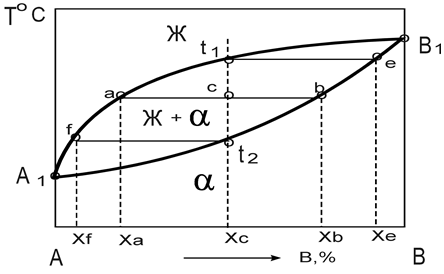
Диаграмма состояния сплавов, компоненты которых ограниченно растворимы в твёрдом состоянии и образуют эвтектику.
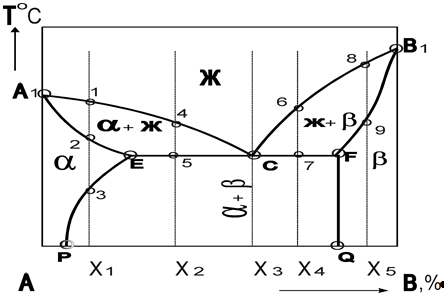
Эвтектическое превращение ЖC > бE + вF.
Диаграмма состояния сплавов, компоненты которой ограниченно растворимы в твёрдом состоянии и образуют перитектику.
Перитектическое превращение Жd + вf > бc.
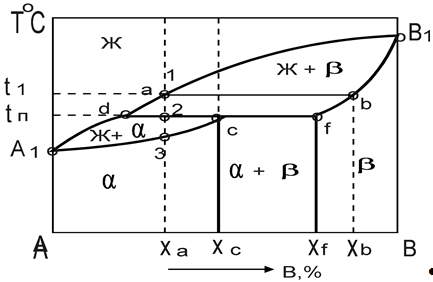
Диаграмма состояния сплавов с полиморфным превращением одного из компонентов.
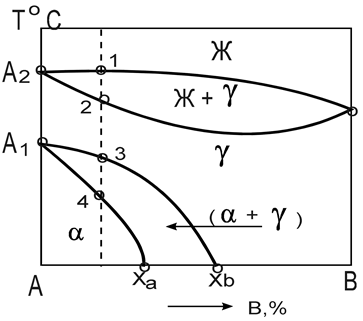
Диаграмма состояния сплавов с полиморфными превращениями компонентов и эвтектойдным превращением.
Эвтектойдное превращение гC > бE + вF.
Физические и механические свойства сплавов в равновесном состоянии. Свойства сплавов в значительной степени определяется фазовым составом, о котором можно судить по диаграмме состояния. Упрочнение при сохранении пластичности твёрдых растворов используют на практике. Так, при растворении в железе кремния или марганца (в количестве2%) прочность увеличивается в 2 раза, а пластичность снижается всего на 10%. Растворение алюминия (в количестве 5%) в меди повышает прочность сплавов в 2 раза, а пластичность остаётся на уровне пластичности меди.
Твёрдые растворы обладают и другими уникальными физическими и химическими свойствами. При растворении Ni (в количестве 30%) в железе теряются ферромагнитные свойства при температурах 20 — 25оС; раствор, содержащий более 13% Cr, применение не только как конструкционные материалы, но и как материалы с особыми делает железо коррозионностойким. В связи с этим твёрдые растворы получили широкое физическими свойствами.
Большой практический интерес представляют технологические свойства твёрдых растворов. Сплавы в состоянии твёрдых растворов хорошо обрабатываются давлением и трудно — резанием. Литейные свойства твёрдых растворов, как правило, не удовлетворительны. Наилучшей жидкотекучестью обладают эвтектические сплавы. Промежуточные фазы в большинстве случаев обладают высокими твёрдостью, температурой плавления и хрупкостью (карбиды, нитриды, бориды, оксиды и др.). Закономерности, отмеченные Н. С. Курнаковым, являются основой при разработке составов сплавов с заданными свойствами.
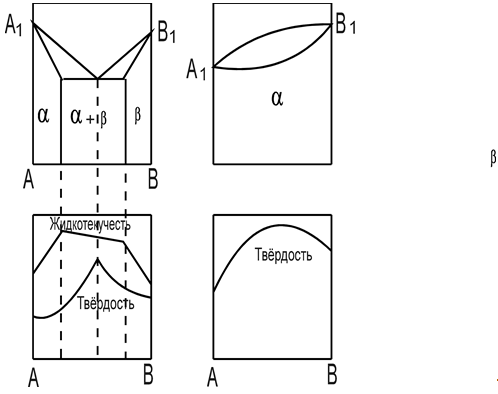
Диаграмма состояния железоуглеродистых сплавов. Fe — C.
Среди диаграмм состояния металлических сплавов самое большое значение имеет диаграмма состояния системы Fe — C. Это объясняется тем, что в технике наиболее широко применяют железоуглеродистые сплавы. Имеются две диаграммы Fe — C:
метастабильная — Fe — Fe3C;
стабильная — Fe — Гр.
Компоненты и фазы в сплавах Fe — С. Железо и углерод — элементы полиморфные.
Железо с температурой плавления 1539оС имеет модификации — б и г. Модификация Feб существует при температурах до 911оС и от 1392оС до 1539оС, имеет ОЦК решётку. Важной особенностью Feб является его феррамагнетизм ниже температуры 768оС, называемой точкой Кюри. Модификация Feг в интервале температур от 911 до 1392оС и имеет ГЦК решётку. ГЦК решётка более компактна, чем ОЦК решётка. В связи с этим при переходе Feб в Feг объём железа уменьшается приблизительно на 1%. Feг — парамагнитно. Углерод существует в двух модификациях: графита и алмаза. При нормальных условиях стабилен графит, при высоких давлениях и температурах стабильным становится алмаз. Фазы в сплавах Fe — С:
жидкий раствор;
феррит — Ф аустенит — А цементит — Ц свободный углерод в виде — Гр.
Ф (феррит) — твёрдый раствор внедрения углерода в Feб. Различают низкотемпературный и высокотемпературный феррит. Столь низкая растворимость углерода в Feб обусловлена малым размером межатомных пор в ОЦК решётке. Значительная доля атомов углерода вынуждена размещаться в дефектах (вакансиях, дислокациях). Механические свойства Ф: ув = 300МПа; д = 40%; ш = 70%; КСU = 2,5 МДж/м2; 80−100 НВ; А (аустенит) — твёрдый раствор внедрения углерода в Feг. Он имеет ГЦК решётку, межатомные поры в которой больше, чем в ОЦК решётке, поэтому растворимость углерода в Feг значительно больше и достигает 2,14%. Аустенит пластичен, но прочнее феррита (160−200 НВ) при температуре 20−25оС. Ц (цементит) — карбид железа Fe3C (почти постоянного состава, 6,67%С). Имеет сложную ромбическую решётку. При нормальных условиях цементит твёрд (800НВ) и хрупок. Теряет ферромагнетизм при Т = 210оС. Температура плавления цементита трудно определить в связи с его распадом при нагреве. Она установлена равной 1260оС при нагреве лазерном лучом. Г (графит) — углерод (100%), выделившийся в железоуглеродистых сплавах в свободном состоянии имеет гексагональную кристаллическую решётку. Графит электропроводен, химически стоек, малопрочен и мягок.
Превращение в сплавах системы Fe — C. Диаграмма состояния Fe — Fe3C характеризует фазовый состав и превращения в системе железо — цементит (6,67%С). Особенность диаграммы — наличие на оси составов двух шкал, показывающих содержание углерода и цементита. Превращение в сплавах системы Fe — Fe3C происходит как при затвердевании жидкой фазы, так и в твёрдом состоянии. Первичная кристаллизация идёт в интервале температур, определяемых на линиях ликвидус (АВСД) и солидус (АНJECF). Вторичная кристаллизация вызвана превращением железа одной модификации в другую и переменной растворимостью углерода в аустените и феррите; при понижении температуры эта растворимость уменьшается. Избыток углерода из твёрдых растворов выделяется в виде карбидов (цементита). В системе Fe — Fe3C происходят три изотермических превращения:
перитектическое превращение на линии HJB (1499оС).
ФН + ЖВ > АJ.
эвтектическое превращение на линии ЕСF (1147о).
ЖС > АЕ + Ц эвтектойдное превращение на линии РSК (727оС).
АS > ФР + Ц Цементит, выделяющейся из жидкости, называют первичным; цементит, выделяющейся из аустенита, — вторичным; цементит, выделяющейся из феррита, — третичным. Железоуглеродистые сплавы подразделяют на две группы:
стали, содержащие до 2,14% С;
чугуны, содержащие более 2,14% С.
Кристаллизация сталей. Кристаллизация чистого железа протекает изотермически при температуре 1539оС, а сплавы железо с углеродом — в интервале температур.
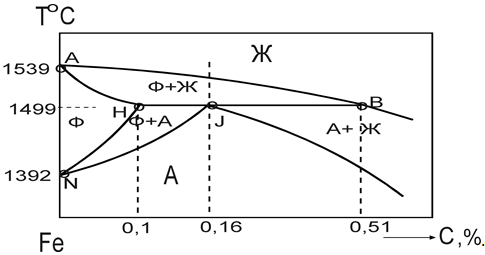
При Т = 14 990С протекает перитектическая реакция.
Фн + Жв > АJ.
Кристаллы феррита взаимодействуют с жидкой фазой, и образуют кристаллы аустенита состава точки J. Согласно правилу фаз перитектический процесс идёт изотермически и при постоянной концентрации фаз, так как число степеней свободы при этом процессе равно нулю. Все сплавы лежащие ниже линий NJ и JЕ, находятся в твёрдом состоянии и имеют аустенитную структуру.
Превращение сталей в твёрдом состоянии. Большинство технологических операций (термическая обработка, обработка стали давлением и др.) проводят в твёрдом состоянии, поэтому более подробно рассматриваются превращения сталей при температурах ниже температур кристаллизации (ниже линии NJE).

Эвтектойдное превращение идёт при постоянной температуре (727оС) и составе фаз (феррит 0,02%С, цементит 6,67%С), так как в процессе одновременно участвуют три фазы (Ф, Ц, А), и число степеней свободы равны нулю.
Превращения чугунов. В сплавах с содержанием углерода более 2,14% С при кристаллизации происходит эвтектическое превращение. Такие сплавы называют белыми чугунами. Сплав с концентрацией 4,3% С — эвтектиеский белый чугун кристаллизуется при эвтектической температуре изотермически с одновременным выделением двух фаз: аустенита состава точки Е и цементита. Образующая смесь этих сплавов при Т = 1147оС названа ледебуритом.
Ж > А + Ц.
При дальнейшем охлаждении концентрация углерода в аустените изменяется по линии ^ ЕS вследствие выделения вторичного цементита и к температуре эвтектойдного превращения принимает значение 0,8%. При температуре линии РSК аустенит в ледебурите претерпевает эвтектойдное превращение в перлит.
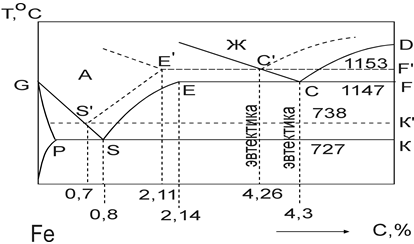
Превращение в сплавах системы FeГр. Чтение диаграммы состояния железо — графит принципиально не отличается от чтения диаграммы состояния железо цементит. Но во всех случаях из сплавов выпадает не цементит, а графит. Графит имеет сложную форму в виде лепестков, выходящих из одного центра. Вторичный графит и графит эвтектоида, как правило, выделяется на лепестках первичного и эвтектического графита. Железоуглеродистые сплавы могут кристаллизоваться в соответствии с диаграммой железо — графит только при весьма медленном охлаждении и наличии графитизирующих добавок (Si, Ni, и др.).
Влияние легирующих элементов на равновесную структуру сталей В качестве легирующих наиболее часто используют следующие элементы: Cr, Ni, Mn, Si, Mo, W, V, Ti, Co, Nb. Реже используются Al, Cu, B и некоторые другие. Почти все легирующие элементы изменяют: температуру полиморфных превращений железа; температуру эвтектойдной и эвтектической реакций; растворимость углерода в аустените; взаимодействия с углеродом образуют карбиды; взаимодействия друг с другом или с железом образуют интерметаллиды.
Принято температуры равновесных превращений, совершающихся в железе и сталях в твёрдом состоянии, обозначать буквой, А с соответствующим индексом. При нагреве — индекс с, при охлаждении — r. Магнитные превращения не имеют гистерезиса.
А0 — т. Кюри, магнитное превращение в цементите. Т = 2300С А1 — эвтектойдная температура, линия РSК. Т = 7270С А2 — т. Кюри, магнитное превращение в феррите. Т = 7680С А3 — температура полиморфного превращения, линия GS. г > б А4 — температура полиморфного превращения, линия NJ. д > г Асm — температура ограниченной растворимости углерода в аустените, линия SE. По влиянию на температуры А3 и А4 легирующие элементы можно разбить на две группы: в первую группу входят элементы, которые понижают А3 и повышают А4. К ним относятся Ni, Mn, C, N и др. Такие сплавы называютаустенитными сталями.
во вторую группу входят элементы, которые повышают А3 и понижают А4. Таких элементов большинство Cr, Mo, W, V, Si, Ti и др. Такие сплавы называют — ферритными сталями.
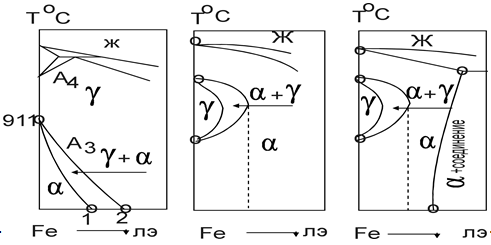
Замкнутая б — область Замкнутая г — область Замкнутые б и гобласти.
физический сталь сплав полиморфный Карбиды в легированных сталях. В сталях карбидообразующими являются следующие элементы: Fe, Mn, Cr, Mo, W, V, Nb, Ti. 1 — 2% карбидообразователей не приводит к образованию карбидов, образуется только легированный цементит, мало отличающийся по свойствам от обычного цементита. Легированный цементит записывают обычно как (Fe, Cr)3 С или (Fe, Mn)3 С или в общем виде Ме3С.
Сильные карбидообразователи — Mo, W, V, Ti — образуют с углеродом фазы внедрения. При этом чаще всего карбиды имеют формулу МС или М2С. Фазы внедрения, отличающиеся очень высокой тугоплавкостью, практически нерастворимы в аустените. Для распада и растворения таких фаз, сталь необходимо нагревать до температур ~ 1300оС. Вследствие нерастворимости фаз внедрения происходит обеднение аустенита углеродом при легировании стали сильными карбидообразователями. Таким образом, в зависимости от легирующего элемента и его количества в структуре легированных сталей могут встретиться следующие типы карбидов: хорошо растворимые в аустените карбиды типа М3С;
трудно растворимые карбиды типов М7С3, М23С6, М6С;
почти нерастворимые в твёрдом состоянии карбиды типа МС.
Влияние легирующих элементов на температуры фазовых превращений сталей при нагреве и на состав точек S и Е диаграммы.
Под влиянием легирования изменяется положение узловых концентрационных точек диаграммы Fe — Fe3C. Большинство легирующих элементов уменьшает растворимость углерода в аустените при всех температурах, что равносильно сдвигу линии SE влево, в сторону меньших концентраций углерода. Максимальная растворимость углерода в аустените (точка Е) наиболее резко уменьшается под влиянием элементов, замыкающих г — область в безуглеродистых сплавах: Cr, Si, W, V, Ti.
Очевидно, что в присутствии этих легирующих элементов ледебурит в структуре сплава появится при меньших концентрациях углерода, чем не в легированных железоуглеродистых сплавах. Например, в стали, легированной 10 — 11% Cr, ледебурит появляется в структуре при содержании углерода ~ 1%. Характерно, что небольшое количество ледебуритной эвтектике при пониженном содержании углерода не снижает способности сплава обрабатываться давлением в горячем состоянии, тогда как нелегированный белый чугун (С > 2,14%) теряет способность к обработке давлением даже при малых количествах эвтектической составляющей структуре. В связи с этим легированные стали, содержащие ледебуритную составляющую, относятся к сталям, а не к белым чугунам и классифицируют как ледебуритные.
Список используемой литературы
- 1. Александров В. М. Курс лекций по материаловедению, 2010г
- 2. Лахтин Ю. М., Леонтьева В. М. Материаловедение, М: — Машиностроение, 1980 г.
- 3. Шмитт-Томас К. Г. Справочник. Металловедение для машиностроения, М: — Металлургия, 1995 г.